循环细胞外小泡(EV)被认为是一种很有前途的诊断生物标志物来源。本研究利用单分子阵列技术(SiMoa)开发了细胞外囊泡免疫测定法,并对其在癌症诊断中的临床应用进行了评价。设计了两种细胞外囊泡检测方法,CD9-CD63和Epcam-CD63测定特异性EV。在肿瘤细胞培养基中检测到的Epcam-CD63水平与从相同细胞系中分离Epcam免疫印记法水平一致。与健康对照相比,在结直肠癌患者中观察到最高的CD9-CD63和Epcam-CD63信号。两种检测均显示出对癌症的卓越诊断性能。结果表明,CD9-CD63 EV检测是无进展生存期和总生存期的独立预后因素,而Epcam-CD63 EV检测是OS的独立预后因子。
题目: Plasma extracellular vesicles detected by Single Molecule array technology as a liquid biopsy for colorectal cancer
单分子阵列技术检测肠癌患者血浆细胞外囊泡
期刊:J Extracell Vesicles 2020年8月
IF:16
上海复旦大学医学院肿瘤科,上海癌症中心-癌症研究所梅里埃实验室
研究背景
细胞外囊泡(EVs)是从正常和异常细胞持续分泌到各种体液中,代表不同大小囊泡的异质混合物。由细胞内起源的两大类EV是外泌体和微泡(MV)。如各种研究所述,外泌体是来源于多泡体(MVB)的小型EV(30–100 nm)。MV是一种中等大小的EV,直径为100至1000纳米的囊泡。EVs携带几种膜结合和跨膜蛋白,代表其细胞起源。例如四跨膜蛋白家族包括CD63、CD9和CD81,主要用作EV/外泌体标记。过多的肿瘤表面标志物,如上皮细胞粘附分子(Epcam)、表皮生长因子受体(EGFR)和CA125,也在肿瘤衍生的EV(T-EV)上表达。使用这些生物标志物来追踪体液中的EVs/T-EVs作为癌症的非侵入性液体活检最近引起了人们的极大兴趣。尽管这种潜在的应用前景广阔,但临床样本中EVs的鉴定和定量仍然具有挑战性。目前,纯化EVs最常见的方法涉及一系列高速超速离心步骤,这非常耗时,不适用于大量临床样本。
单分子阵列(SiMoa)平台是一种新的超灵敏免疫测定技术,允许使用全自动仪器通过ELISA免疫测定来测量蛋白质。通过利用SiMoa,可以在治疗后的癌症预后研究中检测到表达水平非常低的蛋白质生物标志物,从而预测疾病结果。在这项研究中,通过使用SiMoa技术,我们首次开发了两种针对EV标记物的EV检测方法,允许直接从癌症细胞培养物上清液或癌症患者血浆中分析EV或T-EV。此外,我们研究了在结直肠癌癌症(CRC)诊断和预后中的临床应用。
实验方法
1.EVs检测方法建立
根据制造商的建议,制备针对EV生物标志物CD63、CD9和Epcam的捕获和检测试剂。通过使用来自HCT116细胞系(HBM-HCT-30/5,Hansabiomed)的商业EV标准,比较不同的抗体组合,并选择具有最佳信号的抗体组合。文献中使用的抗体为CD9 MA1-19002(ThermoFisher)、CD63 ab59479(Abcam)和Epcam MAB9601(R&D Systems)。
利用SiMoa自制试剂盒使用手册,将捕获抗体浓度调节至0.2mg/mL,并用0.3mg/mL 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)活化顺磁性羧化磁珠(Quanterix)。生物素化反应中,将3μL生物素溶液(2 mg NHS-PEG4-生物素溶于383μL ddH2O中)添加到100μL检测抗体溶液(1.0 mg/mL)中。将回收的抗体的浓度调节至0.2 mg/mL,并将磁珠储存在4°C下。通过此方法开发了两种不同的EVs检测方法:第一种方法通过CD9-CD63检测通用EVs,第二种方法通过Epcam-CD63检测肿瘤衍生的EVs。
2. SiMoa分析验证
通过连续稀释制备从HCT116细胞系分离的商业EV标准品,并用作我们的两种SiMoa EV检测测定(Epcam-CD63,CD9-CD63)的标准品。通过流式纳米分析仪检测纯EV标准品的等分试样,以重新计算初始浓度。标准品的系列稀释液(用Quanterix自制缓冲液稀释7次,每个点稀释5倍)产生7个校准点,用2种SiMoa测定法进行测试。每个稀释点的测量重复3次,以计算检测限(LoD)。对于每个测定,LoD被计算为标准偏差的三倍。
3. EVs纯化
本研究使用差速超速离心法纯化EV。简言之,在收集细胞培养基后,使用低速离心(300g,10分钟)去除死细胞。通过2000g的离心步骤20分钟去除细胞碎片。另一个10000g的离心机步骤40分钟用于去除大的微泡。在100000×g的最终超速离心步骤2小时后收集EV。用PBS以相同的速度和时间洗涤颗粒一次。
实验结果
1.用于检测血浆中EV的SiMoa模型
SiMoa技术利用由飞升大小的反应室组成的阵列,甚至可以检测单个酶分子。近年来,这种方法已被广泛用于各种蛋白质生物标志物的超灵敏检测。将血浆样品与包被有捕获CD9或Epcam抗体的磁珠一起孵育。磁珠-EV复合物依次与生物素化检测抗体CD63和SBG孵育,然后装载到SiMoa圆盘阵列中(图1a)。SBG与RGP的催化反应被限制在微孔中。如果磁珠EV复合物落入孔中,则仪器检测到荧光信号增加。在SiMoa设计中,每个微孔直径为4.5μm,深度为3.25μm。考虑到磁珠的直径(2.7μm),SiMoa微孔能够包含一个磁珠-EV复合物,即外泌体(30–100 nm)和MV(100–1000 nm)(图1b)。使用SiMoa自制试剂盒,开发了两种不同的EV检测方法,CD9-CD63和Epcam-CD63,分别用于通用EV和肿瘤衍生EV检测。

图1 SimoaEV检测模型
2. SiMoa EV检测分析的验证
使用超速离心法从具有高Epcam表达的结直肠癌细胞系HCT116细胞系中分离商业EV标准品(HBM-HCT-30/5,Hansabiomed),并稀释以用作验证两种SiMoa EV检测的标准品,连续稀释中生成标准曲线。CD9-CD63测定的检测限(LoD)计算为34个颗粒/μL(图2a),Epcam-CD63测定的LoD为25个颗粒/微米L(图2b)。此外,还对商业EV标准品进行了超声处理,并用SiMoa分析再次进行了测试,以确认它们能特异性地检测整个EV,但不能检测游离蛋白。图2c显示,超声处理3分钟和10分钟后,两种测定获得的信号都显著降低。超声处理10分钟后,从两种测定中获得的信号都处于背景水平(AEB<0.005),证实这些测定不能检测到游离蛋白。
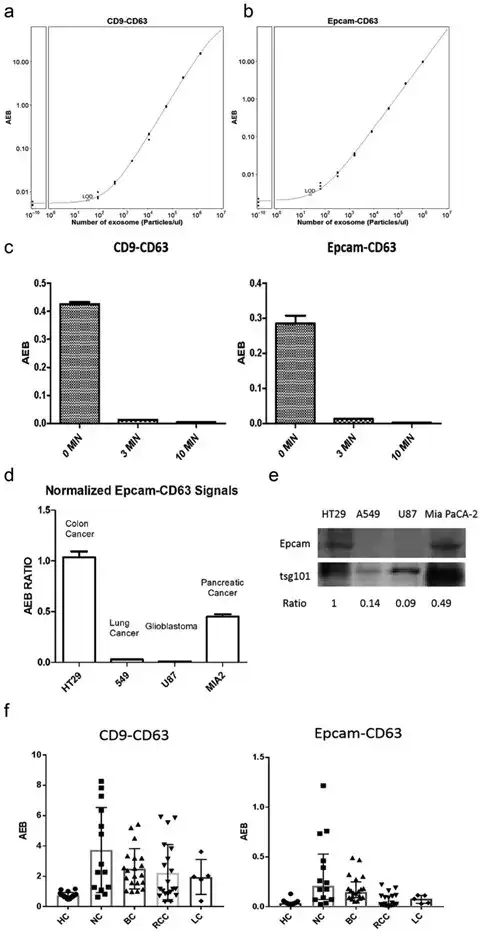
图2 Simoa EV检测的验证
3. 通过Epcam-CD63测定法检测肿瘤衍生的EVs
由于Epcam在各种肿瘤类型中的表达水平不同,我们决定用Epcam-CD63测定法测试来自不同肿瘤细胞系的培养基。使用通用EV测定CD9-CD63获得的信号对用Epcam-CD63测定的信号进行归一化。计算用Epcam-CD63和CD9-CD63获得的平均信号之间的比率。
如图2d所示,HT29细胞系获得了最高的比例,这是一种众所周知的Epcam高表达细胞系。在胰腺癌症细胞系Mia-PaCa-2中也有良好的表达,而在癌症细胞系A549和胶质母细胞瘤细胞系U87中发现非常低的表达。这些结果与用来自相同细胞系的分离的EV从WB获得的Epcam表达水平一致(图2e),表明SiMoa-Epcam-CD63测定检测到的信号反映了直接从肿瘤细胞释放的肿瘤衍生的EV的量。
此外,我们使用SiMoa测定法测试了健康个体(HC,n=20)和癌症患者的几种血浆样本,包括鼻咽癌症(NC,n=14)、癌症(BC,n=2 0)、肾细胞癌(RCC,n=0)和癌症(LC,n=5)患者。有趣的是,大多数癌症患者的通用EV(CD9-CD63)和T-EV(Epcam-CD63)信号高于非癌症患者(图2f)。这些结果证实了在癌症患者中用SiMoa测定法测定EV。
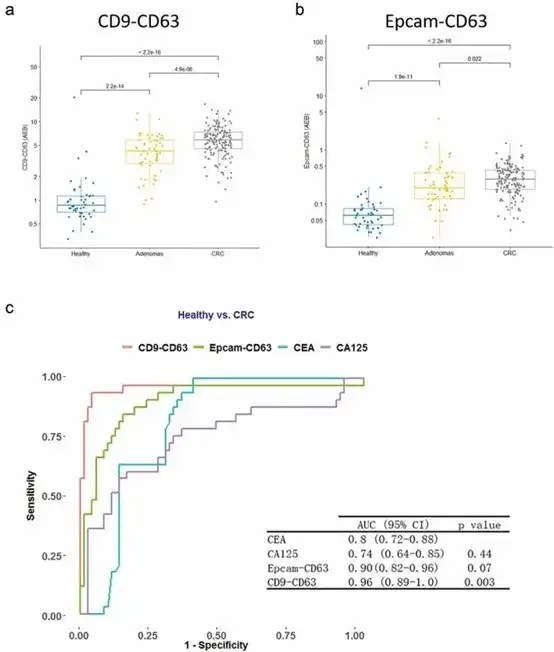
图3 CRC样本中EV检测的诊断价值
4. EVs/T-EVs作为潜在的CRC诊断生物标志物
来自163名CRC患者的血浆样本用SiMoa EV测定法进行了测试,并与46名健康对照(HC)和51名腺瘤(AD)的血浆样本进行了比较 CD9-CD63(图3a)和Epcam-CD63(图3b)。CD9-CD63和Epcam-CD63测定显示出比传统生物标志物CEA和CA125更好的诊断性能(AUC=0.96和0.90,图3c)。CD9-CD63测定显示出最佳性能,AUC=0.96。我们的结果表明,CD9-CD63和Epcam-CD63 EV检测法都有潜力作为CRC的诊断生物标志物,显示出比当前生物标志物更好的性能。
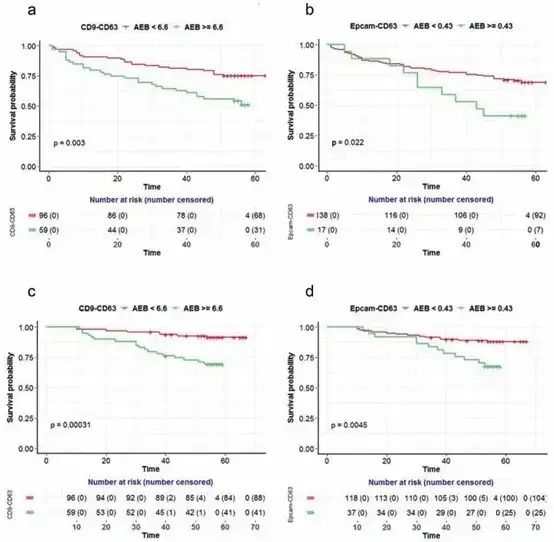
图4 CRC样本中EV检测分析的预测值
5. EVs/T-EVs作为CRC预后生物标志物
为了进行更明显的比较,对EV生物标志物水平高或低的患者组之间的生存差异进行了Kaplan-Meier生存曲线分析。当试图通过EV生物标志物区分两组的PFS和OS时,以最高的Youden指数选择截止值。一致的是,CD9-CD63水平高和低的两组患者的PFS(截止值6.62时p=0.003)和OS(截止值6.70时p=0.00031)的生存曲线显著不同(图4a和c)。然而,与Epcam-CD63的多变量Cox回归结果不同,Kaplan-Meier生存曲线比较显示,具有不同Epcam-CD63水平的两组患者的PFS(截止值0.56时p=0.022)和OS(截止值0.43时p=0.0045)的生存曲线也显著不同(图4b和d)。
结论
结直肠癌在全球总病例中的发病率(10.2%)排名第三,在癌症总死亡人数中的死亡率(92%)排名第二。通过强有力的CRC筛查可以显著降低与该疾病相关的死亡率。目前,结肠镜检查和粪便潜血检查都不能完全满足CRC筛查的需要,分别是因为其程序复杂、侵入性强或筛查效果差。此外,CRC患者管理中最常用的生物标志物,CEA和CA125,提供的敏感性水平不足。在这项研究中,我们利用SiMoa技术,使用Epcam/CD63和CD9/CD63标记物开发了一种无创、全自动和高通量的EV检测方法。并进一步验证了其在CRC诊断和预后中的临床应用。






