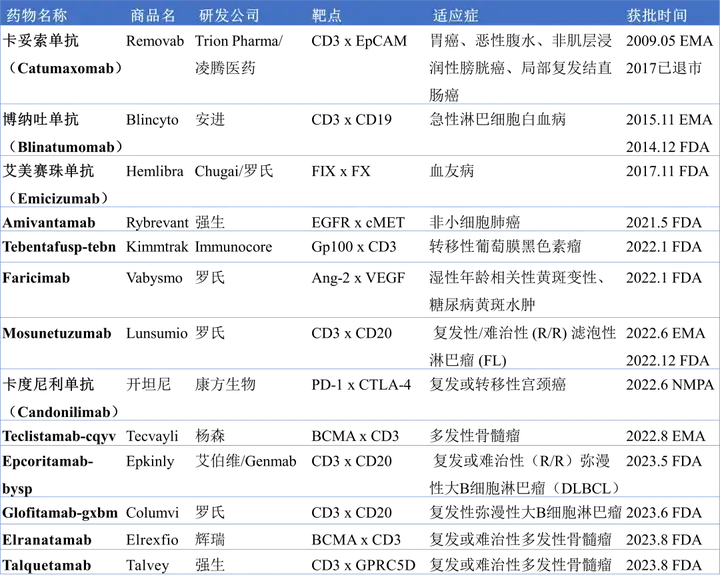
双特异性抗体是指能同时特异性结合两个抗原或抗原表位的人工抗体。双特异性抗体在自然条件下并不存在,而是通过细胞融合或重组DNA技术制备实现的。由于其特异性和双功能性,现已成为抗体工程领域的研究热点,在肿瘤治疗及自身免疫病等领域中具有广阔的应用前景。截止到2023年9月份,全球已获批13款双抗药物(包括已退市的),从2022年初到现在就获批了9款药物(表1)。获批的双抗药物涉及的靶点多样,包括CD3、CD19、EGFR、cMET、PD-1、CTLA-4和BCMA等,探索的适应症包括血液瘤、多发性骨髓瘤、血友病和非小细胞肺癌等。表1. 获批上市的双抗药物
鉴于双抗药物潜在的疗效和安全性优势,国内外企业纷纷布局双抗领域,国内共有300余款双抗在研药物,其中进入临床阶段的药物近100款。康方生物、康宁杰瑞、百济神州、恒瑞医药、信达生物、贝达药业、泽璟制药等深耕于双抗赛道。其中,康方生物的卡度尼利是首款上市的国产双抗药物,今年有望纳入医保。由于工程化双抗拥有两个不同的抗原结合臂,致使其生产制备变成了一个复杂且具有挑战性的过程。具体挑战包括:正确的链配对、同源二聚体污染、产量、正确的蛋白质折叠和翻译后修饰。以抗体设计为主导的解决方案和创新工艺技术的结合使得克服其中许多挑战成为可能,但双抗生产的复杂过程特别需要强大且可靠的表达平台,包括:表达载体:理想表达载体将目标分子所有链以最佳比例进行基因组整合和表达。尽管多表达盒载体可以提供便利,但将双特异性抗体的每一半引入单独的载体中,微调它们各自的表达水平亦可实现最佳配对。细胞系:工程化双特异性抗体的表达需要强大的宿主细胞系,广泛使用的为中国仓鼠卵巢细胞CHO,因为它不仅需要有效的链配对,还需要正确的翻译后修饰、折叠和分泌。早期质量筛选:细胞池和克隆筛选过程中的早期质量分析有助于评估链配对效率、折叠模式和潜在的聚集风险。工艺优化:即使使用优化的细胞系和载体,同源二聚化仍然是双特异性生产的潜在障碍。通过优化细胞培养过程和纯化策略,提高所需分子的产量。本案例以最新的转座子载体为载体平台,尝试在业界推崇的GS 敲除的CHO细胞中表达不对称 4 链双特异性抗体。以获得高表达且正确组装的异二聚体构象为目标,检测CHOSOURCE™蛋白表达平台对双抗细胞株构建的表现。
CHOSOURCE™蛋白表达平台简介
瑞孚迪(Revvity) 公司旗下的CHOSOURCE™蛋白表达平台汇集了强大的谷氨酰胺合成酶敲除 (GS KO) 的CHO 细胞和岩藻糖转移酶敲除的ADCC+ CHO细胞系(可表达完全无岩藻糖基修饰的抗体蛋白)、TnT转座子载体技术。CHO细胞搭载转座子载体用于高效表达单抗,融合蛋白等分子,已经得到多组实验验证。转座子技术带来的目标分子完整高效的基因组整合,显著简化和加速了细胞系开发(CLD)流程。
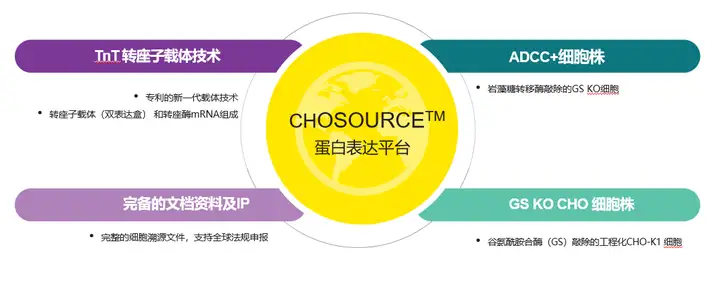
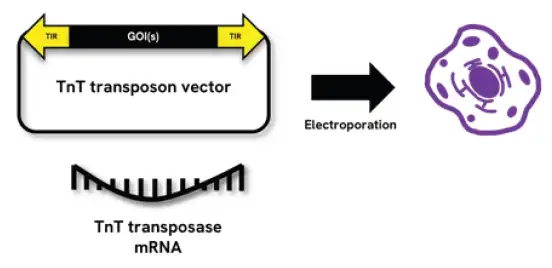
图 1. CHOSOURCE 蛋白平台和CHOSOURCE TnT转座子技术. TnT转座子技术是一个由TnT转座子载体和TnT转座酶mRNA组成的双组分系统。TnT转座子载体本身含2个表达盒。目标基因(GOIs)克隆至载体后,转座酶通过识别载体上的末端反向重复序列(TIR),将含有GOIs(包括GS选择盒)的序列整合到宿主细胞基因组中,实现目标基因的高效完整整合此外,结合瑞孚迪的微流控毛细管电泳分析系统LabChip® GXII Touch™ ,可以实现快速的蛋白关键质量属性分析(纯度,糖型,电荷异质性等),将蛋白质量分析纳入生物治疗工作流程早期,可以显著提高细胞株构建效率和质量控制。
实验设计:不对称 4 链双特异性抗体,由两条轻链(LC1和LC2)和两条重链(HC1和HC2)组成,采用knobs-into-holes结构(图2)。CHOSOURCE TnT 转座子技术由双表达盒转座子载体和TnT转座酶两部分组成,因4链分子的表达需要2个载体,通过四条序列在2个TnT载体上的不同配组得到8种载体和组合(图3) ,两载体间以1:1 比例同TnT 转座酶 mRNA共转染至 GS KO CHO宿主细胞中。
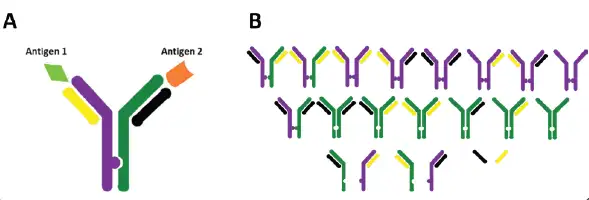
图2. 使用CHOSOURCE TnT转座子技术表达具有knobs-into-holes Fc区域的不对称4-链双特异性抗体[A]。正确的异二聚体抗体[A]会与一些不正确的链组合和自由链[B]共同表达,杂质种类复杂
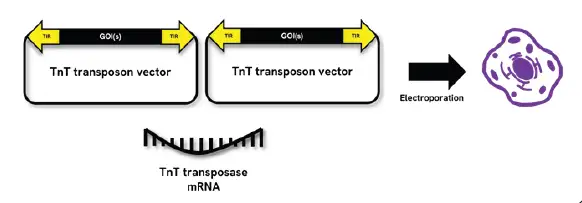
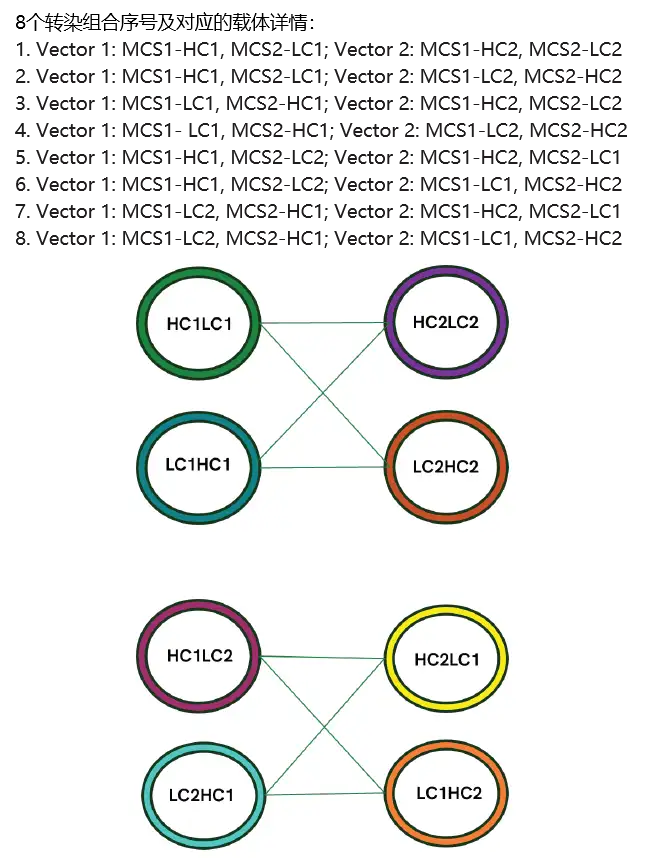
图 3. 使用 CHOSOURCE TnT载体表达 4 链双特异性抗体,两个 TnT 转座子载体与 TnT 转座酶 mRNA 共转染GS KO 的CHO 细胞。图示本测试中构建的8个不同的载体, 8种不同转染组合条件下各个载体的配组情况
实验结果:
转染后无需选择剂甲硫氨酸亚砜亚胺(MSX),6个组合的细胞池在8~13天即完成筛选恢复,2个恢复慢的组合在16天时达到培养阶段(图4)。恢复时间的差距表明每个载体内的抗体链位置对细胞池的选择恢复有影响,这可能是由于不同位置的抗体链的表达水平不同。
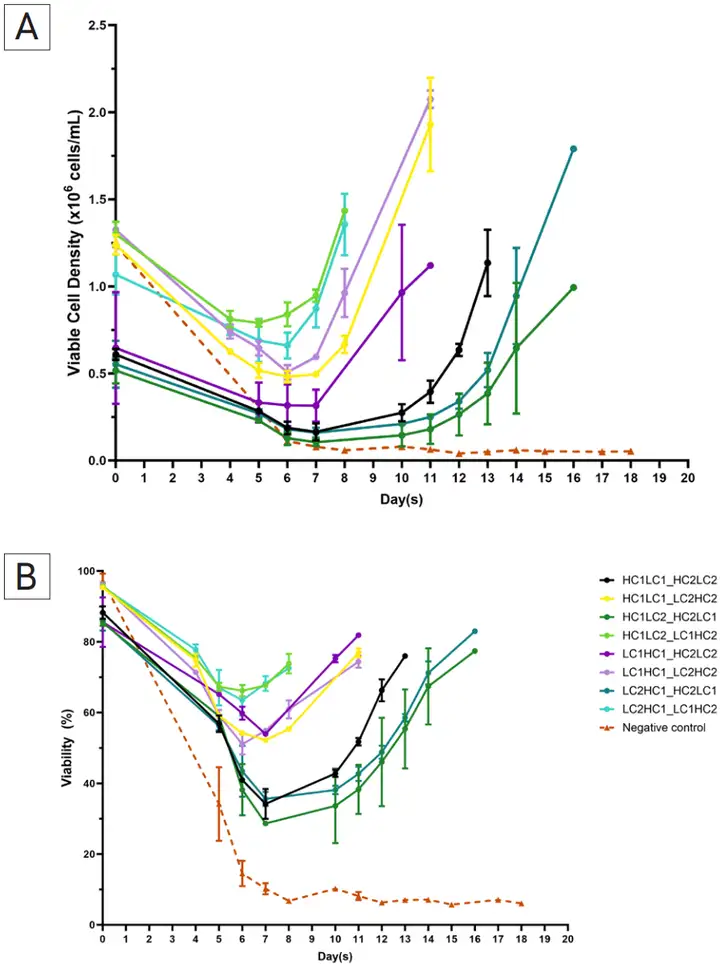
图4. 共转染后细胞池的选择恢复概况。图(A)代表活细胞密度,图(B)代表活力百分比。误差线代表两个独立转染细胞池的标准偏差评估每个细胞池中载体的整合情况(图5),我们发现同一表达载体中的 HC 和 LC 及GS基因以 1:1:1 的比例整合到每个细胞池中。例如,在共转染条件3中,载体1中LC1和HC1确定的拷贝数均为15,载体2中HC2和LC2确定的拷贝数为11,它们组合起来与观察到的 GS 基因的 26 个拷贝相匹配。8个pool中GS 基因拷贝数基本等于两个重链或轻链的所在载体拷贝数之和,同以往的实验结果相一致,说明了TnT 转座酶介导完整的目标序列转座。
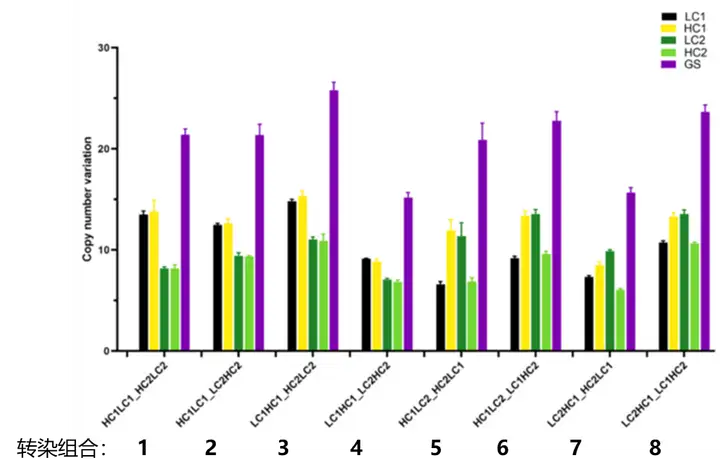
图5. 不同转染组合条件下目标基因拷贝数插入情况。筛选恢复后每个共转染组合条件下细胞池中四条目标抗体序列(LC1、HC1、LC2、HC2)和筛选基因GS的插入拷贝数检测 (ddPCR方法,每个样本三次重复)由于两载体以 1:1 的比例共转染,预计每个库中会整合相同数量的四个链拷贝。实际情况并非如此。仅转染组合条件 4、7 和 8下,所有四个链的数量几乎相等;在共转染条件 1 中,含有“knobs”HC (HC2) 的载体比含有“holes”HC (HC1) 的载体整合更少的拷贝数(7:14;大约一半),这也意味着可以调整载体的比例,以增加特定分子的整合。
恢复后的8组测试细胞池经14天的简单fed-batch培养(培养条件未优化),初步评估哪个组合配置产能有优势。双抗的产量数据显示:具有相似拷贝数的六个共转染池的抗体产量在相同范围内,并且高于1g/L,而其余两个池拷贝数最少,产量也较低(图6)。“LC1HC1_HC2LC2”(共转染条件 3)配置具有最高数量的整合拷贝,产生了最高的总体抗体滴度。
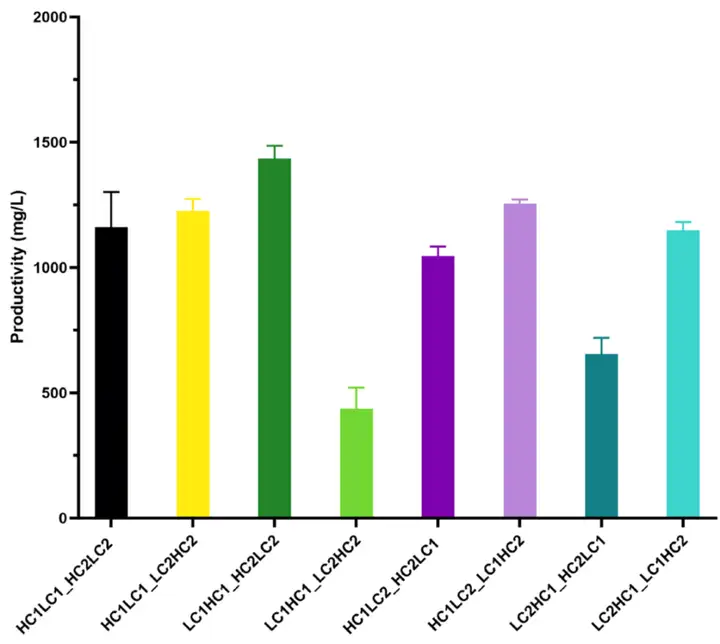
图 6. 八个共转染细胞池的双抗生产力初步评估(14天fed-batch 培养)使用微流控毛细管电泳LabChip GXII Touch HT 系统,利用 ProteinEXact 试剂盒进行八组载体配置下纯化抗体的非还原和还原电泳分析,并与参考双特异性抗体对照进行比较(图7,表2)。微流控毛细管电泳技术可以可以根据蛋白质的大小,高效分离非还原样品的不同构象,如异二聚体、同二聚体、糖基化和非糖基化变体以及游离链等,速度达到~1分钟/样品,并具备灵活通量(1-384样本/轮),对于分析还原样品,可以实现单个抗体链的鉴定和定量。比较八个载体配置下蛋白电泳图谱发现(图7),虽然“LC1HC1_HC2LC2”(共转染条件3)具有最高的抗体滴度,但表达的抗体谱与参考分子不同。共转染生成该池的两个载体内两条重链和轻链的前后位置导致 LC2 链表达减少,这可能妨碍了分子的正确组装。结合还原蛋白电泳图谱,“LC2HC1_LC1HC2”(共转染条件 8)显示出更多优势,不仅峰型与对照分子相近,四个抗体链的存在比例与参考分子的比例也非常相似。
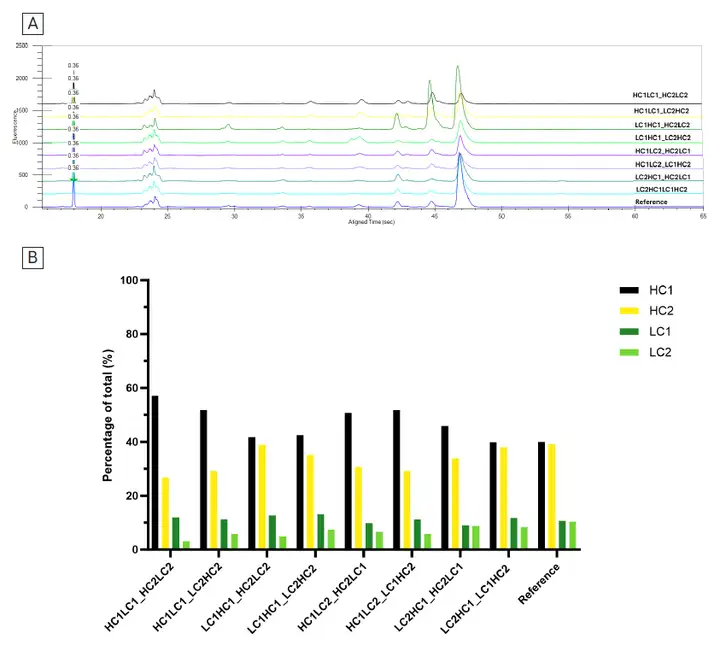
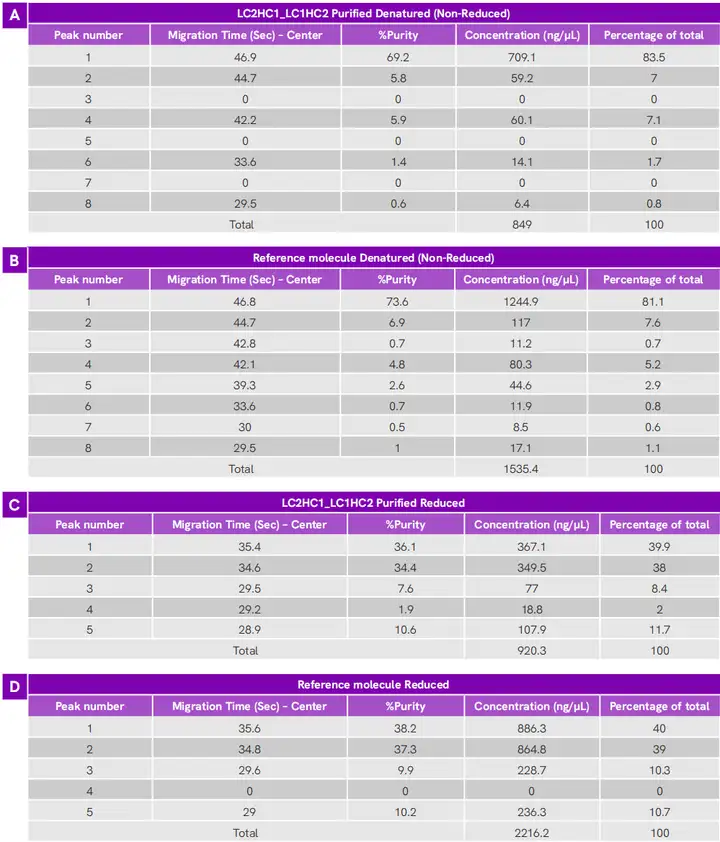
图 7. LabChip GXII Touch HT 系统评估 8 个配组组合及参考双抗的非还原和还原状态下蛋白的μCE-SDS情况。非还原蛋白样品的电泳图谱如 [A] 所示。还原蛋白样品的电泳图谱见[B]图,条形图代表各条链的浓度百分比(%)利用LabChip GXII Touch HT的软件细致分析“LC2HC1_LC1HC2”(共转染条件 8)产生的抗体异构体与参比分子的异同(表2),共转染条件 8虽然表达滴度比条件 3 稍低(1.2g/L vs 1.4g/L),但构象正确率达到94%。是这批实验中综合表现良好的组合,鉴于产量和质量评估对于确定细胞系开发流程中最佳细胞池同样重要,共转染条件 8得到的细胞池适合进入下一步单克隆筛选 。表2. 对于LC2HC1_LC1HC2(共转染条件 8)样本抗体,微流控毛细管电泳中的各个峰相对于参考双抗分子的蛋白质量分析。[A,B] 非还原蛋白样品的各峰比较, [C,D] 还原蛋白样品的各峰比较
结论在这项工作中,我们使用 CHOSOURCE TnT 转座子载体技术表达不对称 4 链双特异性抗体。初次尝试变获得高表达且正确的异二聚体构象是双抗生产的目标(条件8)。本研究只测定了两种载体以 1:1 的共转染比例产生的正确抗体构型的情况,由于双特异性抗体的基因组整合和表达的动力学的复杂性,两个载体还可以尝试以不同的比例共转染以产生更佳的正确的异二聚体配置。CHOSOURCE TnT 转座子技术双盒载体提供了调节双特异性抗体不同链表达的灵活性。这不仅可以通过测试两个载体不同比例的共转染来实现,还可以通过测试不同的链位置来实现。CHOSOURCE TnT 转座子技术搭载 GS KO 细胞系,能够在转染后约6 周内评估细胞池阶段的蛋白质质量,鉴于转座子带来的完整高效整合,有助于高效实现CLD的开发。双特异性抗体分子设计的进步,例如knobs-into-holes 结构,显著减少了错配和同源二聚体污染。然而,“孔-孔”同二聚体和共纯化的游离链仍然存在挑战,故在细胞系开发过程的早期纳入质量分析变得很关键。瑞孚迪 的微流控毛细管电泳 LabChip GXII Touch HT 系统,高效率分析还原和非还原样本的多项蛋白表征(滴度,纯度,电荷异质性,片段化,聚体,糖基化程度及糖谱等),1分钟/样本的速度和1-384样本/轮的灵活通量,可进一步提高生物制品开发的速度。在本研究中,LabChip GXII Touch HT 系统可以对细胞池表达的抗体进行快速表征分析,可以帮助在细胞系开发时及早识别最佳的细胞池。总之, 瑞孚迪 的 CHOSOURCE 表达平台和 LabChip GXII Touch HT 系统的强强联手,可以最大程度的简化和加速复杂抗体类分子的细胞系开发过程,促进生物治疗药物的开发和进步。













