备受瞩目的2024年第115届美国癌症研究协会(AACR)年会于4月5-10日在美国圣地亚哥召开。今年的大会以“激励科学·推动进步·革新诊疗”为主题,旨在汇聚全球肿瘤研究领域的顶尖专家学者,共同探讨肿瘤早期研究与创新进展。
布鲁克细胞分析旗下的单细胞光导系统和单细胞功能蛋白组学平台,在本次会议展示的研究项目中扮演了重要角色。这些技术已经被应用于诸多科研实践之中,携手全球的科学家及生物技术令居企业,共同推进新型肿瘤治疗策略的研发。借助单细胞层面的功能特性分析,深挖肿瘤科学的位置领域,促进精准医疗与个性化治疗方案的发展。
1
DKFZ 德国癌症研究中心
利用布鲁克单细胞光导系统鉴定肿瘤特异性T细胞用于个体化T细胞疗法开发
相比于CAR-T和肿瘤进入淋巴细胞疗法,TCR-T细胞可能在体内表现更长的持久性,并可以介导持续的抗肿瘤作用。此外,TCR-T细胞能够靶向CAR-T细胞无法接触的细胞内抗原,从而扩大了免疫治疗的潜在靶点范围。这项研究的目标是鉴定针对自体骨髓瘤细胞的TCR。
研究者使用布鲁克细胞分析的单细胞光导平台识别肿瘤反应性T细胞,OptoSelect 1500芯片上同时对多达1500个单独的T细胞/靶细胞相互作用进行功能分析(Beacon Quest单细胞光导系统搭载的OptoSelect 3500芯片可实现更高通量T细胞功能研究)。通过检测分泌的细胞因子(IFNγ、TNFα、IL2)和4-1BB (CD137) 表面表达测定来鉴定反应性T细胞。在每位骨髓瘤患者中检测到显示出各种细胞因子分泌模式和4-1BB表达谱的肿瘤反应性T细胞。肿瘤反应性T细胞被以单细胞的形式分离出来,并对它们的TCR进行测序。将肿瘤反应性T细胞的TCR序列映射到来自同一患者的T细胞的单细胞RNA测序数据,以揭示骨髓瘤反应性T细胞的基因表达特征。反应性T细胞的TCR基因被克隆并在自体T细胞中过表达,用于肿瘤衍生新表位特异性的功能验证和分析。
综上所述,该研究团队提出了一种创新方法,能够有效识别骨髓瘤特异性T细胞,并从中发掘出适用于个体化T细胞治疗的真正具有肿瘤反应性的TCR,为个体化肿瘤免疫治疗提供了新的突破性路径。
图1. 布鲁克细胞分析的单细胞光导系统T细胞功能表征示意图
2
Biocytogen Pharmaceuticals 百奥赛图
开发靶向突变KRAS蛋白的新型TCR-mimic全人抗体
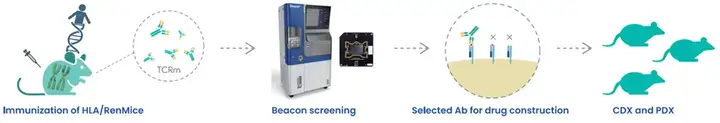
突变型KRAS蛋白因其在多种实体瘤中频繁而特异性的表达特征,成为了极具吸引力的癌症治疗靶点。特别是在人类结直肠癌和胰腺导管腺癌中,相当大比例的病例存在肿瘤驱动的KRAS基因G12V/G12D突变,然而目前尚未有针对这两种突变的有效药物,凸显出临床上亟待填补的巨大需求缺口。尽管小分子药物难以直接靶向KRAS G12V/G12D突变,但TCR类似物(TCR-mimic)抗体却展现出了针对性识别由人类白细胞抗原(HLA)呈递的KRAS突变的独特能力,从而为攻克这类细胞内抗原开辟了全新的途径。
在此项研究中,科研人员利用百奥赛图公司的RenTCR-mimicTM专利小鼠模型进行免疫,并结合基于Beacon单细胞光导技术的高通量筛选平台,成功鉴定出了一批对G12V/HLA和G12D/HLA复合物具有极高特异性的新型抗体。 相较于天然存在的内源性TCR,这些TCRm抗体具有更强的亲和力,有助于降低肿瘤逃避免疫监视的风险。系统发育分析显示,这些抗体具有高度的序列多样性和可能的不同表位靶向性。值得注意的是,尽管胰腺癌因其治疗难度大、细胞表面KRAS突变肽-HLA复合物表达量极低,但当这些TCRm抗体组装成为CD3 T细胞接合器后,仍然在体外实验中展现了强大的肿瘤杀伤活性。此外,这些抗体还通过严格的测试,证明了卓越的安全性,避免了非特异性靶向。
总结而言,本研究揭示了这些针对KRAS突变靶点的TCRm抗体在实体瘤治疗领域具有广阔的应用前景和显著的治疗潜力。
图片来源:百奥赛图官网
3
维克森林大学医学院
患者来源肿瘤芯片培养增强针对原发性肿瘤细胞的适应性免疫反应
研究者们设计了一种创新的3D Tumor On Chip(TOC)平台,该平台能够模拟真实的肿瘤微环境,并利用微流控技术实现患者来源肿瘤类器官与自体外周血单核细胞(PBMC)共培养。在该装置中,PBMCs经历连续循环,直接接触由患者自身肿瘤衍生的多克隆新抗原,进而促使这些PBMC转化为具有高度针对性和抗肿瘤活性的类器官相互作用淋巴细胞(OIL)。
为了验证TOC平台的有效性,研究团队从15例手术患者中获取了样本材料,将患者的肿瘤细胞与自体抗原呈递细胞在三维(3D)支架内整合构建出肿瘤类器官。接着,在TOC系统中让自体PBMC与这类肿瘤类器官共同培养,以生成免疫增强型的OIL;而未经TOC系统处理的PBMC以及来自肿瘤内部的淋巴细胞作为对照组。通过采用布鲁克公司的单细胞功能蛋白质组学技术和CodePlex芯片分析,研究者对OIL及其CD8+对照细胞的功能进行了详尽的检测,尤其是比较它们分泌细胞因子的多功能性。结果显示,经过TOC系统训练后的CD8+ OIL表现出明显的多功能性提升,尤其是增强了效应T细胞相关的细胞因子如INF-γ、颗粒酶B和穿孔素的分泌。当将OIL与对照组一起重新引入到肿瘤细胞共培养体系中时,OIL分泌的促炎细胞因子IFN-γ、MCP-1及颗粒酶A显著增多(p<0.05)。 更重要的是,OIL在面对再次暴露的肿瘤细胞时,能够有效激活细胞毒性淋巴细胞,导致肿瘤细胞死亡率显著提高(p<0.05)。
综上所述,与对照组相比,TOC系统所产生的OIL展现出了更强的细胞毒性淋巴细胞多功能性和诱导肿瘤细胞凋亡的能力,这一效果不依赖于特定的肿瘤类型。鉴于此,研究者提出了一个新的潜在的过继细胞疗法模型,有望针对目前常规疗法难以攻克的多种肿瘤类型,提供更有效的个体化免疫治疗方案。
上下滑动,查看更多
4
弗吉尼亚大学
使用低甲基化剂重塑大颗粒淋巴细胞白血病的表观基因组
大颗粒淋巴细胞(LGL)白血病是一种罕见的异质性血癌。由于尚无FDA批准的治疗LGL白血病的抗肿瘤药物,科研人员正在积极探索新的治疗策略。
由于DNA高甲基化是LGL白血病的一个新兴标志,研究者评估了两种表观遗传药物阿扎胞苷(AZA)和克拉屈滨(CLAD)的治疗潜力,它们分别直接和间接抑制DNA高甲基化。研究者假设AZA和CLAD将1) 表现出细胞内在功效,2)通过DNA低甲基化重新编程LGL白血病的表观基因组,以使异常基因表达正常化,3)诱导细胞因子介导的免疫反应。 通过Cell Titer Glo活力测定在人LGL白血病细胞系中评估AZA和CLAD细胞毒性。每一种都表现出有效的抗白血病作用,IC50值在低微摩尔和纳摩尔范围内。Western blotting分析表明,治疗后DNA甲基转移酶的蛋白表达和磷酸化STAT3水平呈时间和剂量依赖性下降。研究者还探讨了这些低甲基化药物的免疫调节作用,因为LGL白血病是一种具有细胞毒性淋巴细胞的促炎性恶性肿瘤。使用布鲁克单细胞功能蛋白组分析平台的初步研究结果表明,AZA和CLAD诱导LGL白血病细胞产生抗炎细胞因子。 正在进行的研究将使用AZA或CLAD处理样本的RRBS、ATAC-seq和RNA-seq来确定差异甲基化、染色质可及性和基因表达,以定义DNA去甲基化的机制和后果。发现AZA和CLAD的重编程能力可能会重新利用这些抑制剂来治疗LGL白血病患者。
上下滑动,查看更多
5
罗斯威尔公园综合癌症中心
NK受体让TCR介导的CTL能够识别和杀伤表达非突变肿瘤相关抗原的癌细胞
在免疫系统中,树突状细胞(DC)在向幼稚T细胞呈递抗原过程中扮演重要角色,其中CD28驱动的”信号2”对于有效激活T细胞反应至关重要。然而,在针对肿瘤相关抗原(TAA)的反应中,如何确保激活的杀伤性T细胞(CTL)能够区分并针对性地攻击癌细胞,而不是对表达同样非突变TAA的健康细胞产生自身免疫反应,是一个有待深入理解的问题。由于CD8+ T细胞表达激活NK受体(NKR),并且NKR配体通常由癌细胞而非健康组织表达,因此研究者评估了DC引发的TAA特异性CTL识别癌细胞期间NKR和TCR之间的串扰。
TCGA分析显示DNAM-1和NKG2D与瘤内CD8+ T细胞而非NK细胞密切相关,这对于黑色素瘤患者的长期生存至关重要。与初始CD8+ T细胞相比,人DC引发的CTL显着上调DNAM-1和NKG2D,但在癌细胞识别中保留了对TCR的严格依赖。出乎意料的是,DNAM-1和NKG2D的阻断阻止了TCR介导的CTL对表达低TAA水平的癌细胞的识别和杀伤,但在识别高TAA水平表达的癌细胞时是多余的。研究者使用IsoSpark单细胞功能蛋白组分析平台、钙流、蛋白质印迹和RNA测序分析NKR介导的共刺激的机制和分子效应,发现DNAM-1以及较小程度的NKG2D降低了TCR激活阈值并增强了近端TCR信号传导和CTL的多功能性。 TCR转基因T细胞中的NKR过度表达或化疗驱动的癌细胞上NKR配体的升高可以有效识别和杀死弱免疫原性癌细胞。NKR共刺激存在时TCR激活阈值降低,使得癌细胞上低水平的同源 MHC I-肽复合物能够激活CTL。这些数据有助于解释未突变的“自身”抗原在缺乏自身免疫的情况下介导肿瘤排斥的能力,并提供了增强癌症治疗有效性的新工具。
上下滑动,查看更多
6
乔治城大学
黑色素瘤肿瘤内巨噬细胞过继细胞疗法对肿瘤微环境进行重编程
肿瘤微环境(TME)内肿瘤细胞和免疫细胞之间的相互作用决定促肿瘤或抗肿瘤免疫反应。肿瘤相关巨噬细胞(TAM)对ME信号做出反应,并表现出介于M1和M2巨噬细胞之间的一系列表型。在大多数肿瘤类型中,包括黑色素瘤,M1和M2巨噬细胞之间的平衡至关重要,较高的 M1/M2 比率有利于抗肿瘤免疫。因此,提高 M1/M2 比率的策略可以显着改变TME的抗肿瘤免疫能力。在这项研究中,我们分别通过静脉内 (iv) 和肿瘤内途径将荧光素酶和表达 GFP 的M1巨噬细胞作为过继细胞疗法注射到携带SM1 鼠黑色素瘤肿瘤的小鼠中,以确定有效的治疗方式。我们用HDAC6抑制剂对抗肿瘤M1巨噬细胞进行离体重新编程,以锁定M1表型,并在同基因SM1小鼠黑色素瘤和人源化NSG-SGM3黑色素瘤模型中以ACT瘤内给药。我们对肿瘤进行了巨噬细胞标记物的组织学分析、浸润免疫细胞的免疫表型分析、肿瘤巨噬细胞的单细胞分泌组分析以及CD45+免疫细胞群的单细胞RNA-seq分析,以证明巨噬细胞ACT的益处。其中IsoSpark单细胞功能蛋白组分析平台对F4/80+ TAM的单细胞分泌组分析揭示了HDAC6处理的M1巨噬细胞的多功能性,可分泌炎症细胞因子TNFα和T细胞募集趋化因子CXCL10。 对肿瘤切片进行巨噬细胞表型标记物的组织学检查表明,在SM1小鼠和NSG-SGM3黑色素瘤肿瘤模型中,移植的巨噬细胞在ACT后保留了M1表型。研究者证明了用HDAC6抑制剂离体重编程巨噬细胞作为治疗实体瘤的可行巨噬细胞疗法的潜力。
上下滑动,查看更多
7
伊利诺伊大学芝加哥分校
硬脂酸诱导促炎巨噬细胞反应对肺癌发展的重要性
研究团队发现在可切除的早期肺癌患者中,硬脂酸(SA)和巨噬细胞炎症蛋白1β (MIP-1β/CCL4) 水平升高可预测肿瘤影响的肺叶。研究者假设SA通过激活巨噬细胞(MΦ)和产CCL4等促炎细胞因子来促进肺癌发生。他们利用LC-MS对不同阶段肺癌患者的血浆进行非靶向代谢组学分析,发现早期肺癌患者的SA水平升高。为了进一步研究SA在肿瘤发生中的机制作用,用SA处理包括永生化肺上皮细胞、肺癌细胞和免疫(MΦ和T)细胞在内的细胞系。SA的生理浓度不影响细胞活力。然而,在MΦ中,SA诱导炎症和免疫调节基因的表达,表明SA在促进促肿瘤免疫状态中发挥作用。此外,使用单细胞蛋白质组分析(Isolight,Bruker Cellular Analysis,Inc)对SA刺激的MΦ的分泌组进行分析,表明多功能MΦ显着富集,并增强了富集效应子和刺激性细胞因子的分泌。此外,源自SA刺激的MΦ的条件培养基导致 BEAS2B 永生化肺上皮细胞的增殖增加以及贴壁独立生长。
这些数据表明与晚期肺癌患者相比,早期肺癌患者血浆SA水平升高。SA对MΦ的影响对于肺癌启动至关重要,不仅增加增殖,而且诱导永生化肺上皮细胞的肿瘤转化。此外,我们的数据表明,SA的血浆水平也可以用作肺癌发展高风险个体以及早期疾病患者的肺癌发展的潜在生物标志物。
上下滑动,查看更多