目的
利用一种新的数据驱动方法评估帕金森病(PD)中几种常见生物标志物变化的顺序。
方法
纳入了来自帕金森进展标志物计划(PPMI)的374名PD患者和169名健康对照(HC)。生物标志物包括左壳核纹状体结合率(SBR)、右壳核SBR、左尾状核SBR、右尾状核SBR、脑脊液α-突触核蛋白、血清神经丝轻链(NfL)。采用判别事件模型(discriminative event-based model, DEBM)对生物标志物变化顺序进行建模,建立疾病进展时间表。通过交叉验证获得每个受试者的预估疾病阶段。采用Spearman相关法探讨疾病分期与帕金森病临床症状之间的关系。
结果
所选生物标志物中,左壳核是出现异常最早的,其次为右壳核、脑脊液α-突触核蛋白、右尾状核、左尾状核和血清NfL。疾病阶段在PD和HC之间存在显著差异,并且对PD和HC的区分准确度很高,曲线下面积(AUC)为0.98,灵敏度为0.95,特异性为0.92。此外,预估疾病阶段与日常生活的运动经历、运动症状、自主神经功能障碍和PD患者的焦虑等因素相关。
结论
使用DEBM确定了PD中几种常见生物标志物变化的顺序,提供了PD疾病进展的数据驱动证据。
1. 背景
帕金森病是一种常见的神经退行性疾病,其特征是震颤、运动迟缓、强直和姿势不稳。帕金森病的典型病理特征是黑质中多巴胺神经元的进行性变性和路易体中α-突触核蛋白的沉积。基底神经节中的多巴胺缺乏以及其他神经递质改变,如去甲肾上腺素、血清素、γ-氨基丁酸 (GABA)和谷氨酸,一直被报道是导致 PD 的病理生理学基础。普遍认为帕金森病是一种涉及多种病因和发病机制的多因素疾病。帕金森病的发展是由衰老、遗传和环境因素之间复杂的相互作用驱动的。几种潜在的 PD 机制包括线粒体功能障碍、囊泡转运异常、错误折叠的蛋白质聚集、兴奋性毒性、神经炎症和氧化应激。帕金森病的起病是隐匿的,当患者表现出典型的临床表现时,超过 50%-70% 的多巴胺能神经元退化。由于疾病进展的渐进性和不可逆性,目前尚无预防帕金森病进展的根治性治疗方法。因此,对于精准医学来说,识别可观察到的生物标志物变化并建立帕金森病的疾病进展时间表至关重要。
在帕金森病的发生发展过程中,一系列重要的病理变化和异常标志物不断出现。先前的研究报道了帕金森病中一些有意义的成像和体液生物标志物,例如代表突触前多巴胺能完整性的多巴胺转运蛋白(DAT)摄取、路易体病理学的生物标志物脑脊液 (CSF) α-突触核蛋白,和轴突损伤的标志物神经丝轻链蛋白 (NfL), 这些生物标志物为帕金森病提供了诊断和预测价值。然而,针对这些多模态生物标志物变化顺序的PD研究很少。
基于判别事件的模型(DEBM)是一种新颖的数据驱动方法,可以推断生物标志物异常顺序并使用横断面数据评估疾病进展时间表。DEBM主要基于真实世界数据,而不是依赖于已建立的临床标签或生物标志物临界值。最近,DEBM 和类似的基于事件的模型已被广泛用于表征各种疾病的疾病进展轨迹,例如 PD、 阿尔茨海默病 (AD)、额颞叶痴呆 (FTD)肌萎缩侧索硬化症(ALS)、进行性核上性麻痹 (PSP)和多发性硬化症。先前研究的结果表明,DEBM是一种很有前途的技术,用于评估生物标志物的演变和动态疾病进展。因此,该研究旨在应用 DEBM 来评估 PD 中几种常见生物标志物变化的顺序,包括 DAT 摄取、脑脊液α-突触核蛋白和血清 NfL。
2. 方法
2.1 研究对象
该研究使用了来自帕金森病进展标志物倡议(PPMI)数据库的374名PD患者和169名年龄和性别匹配的健康对照(HC)的基线数据。PPMI 是一项多中心、前瞻性研究,旨在寻找和识别 PD 进化和进展的生物标志物。本研究数据于2022年4月11日(http://www.ppmi-info.org/data )从PPMI下载。PPMI 招募的 PD 患者 (1) 年龄超过 30 岁,(2) 在 2 年内被诊断为 PD,(3) 未接受抗帕金森病药物治疗,(4) H-Y 分期 ≤2,以及 (5) 在 SPECT 上出现纹状体 DAT 缺陷。参加 PPMI 的 HC 没有神经系统疾病,一级家庭成员没有 PD 病史,认知正常。
2.2 生物标志物选择和实验室方法
该研究选择了与帕金森病密切相关并被广泛研究的生物标志物,包括左壳核SBR、右壳核SBR、左尾状核SBR、右尾状核SBR、脑脊液α-突触核蛋白和血清NfL。计算SBR的ROI。使用单分子阵列 (Simoa) 技术定量检测血清NFL浓度情况。根据标准化程序通过腰椎穿刺获得脑脊液,并使用 BioLegend 的市售ELISA 试剂盒测量 α-突触核蛋白。
2.3 临床评估
本研究中的所有受试者都使用标准量表,运动障碍协会统一帕金森病评定量表 (MDS-UPDRS) 第一部分用于测量日常生活的非运动体验,第二部分评估了日常生活的运动体验,第三部分用于评估 PD 的运动症状。使用宾夕法尼亚大学嗅觉识别测试 (UPSIT) 评估嗅觉功能。使用 Epworth 嗜睡量表 (ESS) 评估白天过度嗜睡。使用快速动眼睡眠行为障碍筛查问卷 (RBDSQ) 评估快速动眼睡眠行为障碍。抑郁和焦虑的评估分别基于老年抑郁量表(GDS)和状态-特质焦虑指数(STAI)。使用帕金森病-自主神经功能障碍预后量表 (SCOPA-AUT) 测量自主神经功能障碍。使用蒙特利尔认知评估 (MoCA) 评估认知。
2.4 统计分析
所有数据均使用直方图和 Kolmogorov-Smirnov 检验进行正态分布检验。分别采用Mann-Whitney U检验和χ2检验比较PD组和HC组。通过Spearman相关性评估个体疾病分期与PD临床特征之间的相关性。
所有偏态分布的生物标志物均进行对数变换,以增强数据的正态性,提高模型的准确性。DEBM 中的生物标志物是使用对数转换值进行的。本研究中选择的生物标志物显示 PD 和 HC 之间存在显着差异 (p < 0.05),因为 DEBM 模型中的数据分布必须充分分离。所有数据在建模前都针对性别和年龄进行了校正。所有统计分析均使用Python、SPSS和GraphPad Prism软件进行。
2.5 DEBM 及验证
该研究使用了 Venkatraghavan 提出的 DEBM 方法来估计 PD 中生物标志物变化的顺序。研究基于 PD 和 HC 患者的横截面数据,每个患者都进行了相关生物标志物测试。首先,应用高斯混合模型(GMM)拟合所有受试者的生物标志物分布,并计算每个受试者生物标志物异常的概率。因此,根据这些生物标志物的概率分布构建了特定于每个受试者的一系列事件。DEBM 中的事件被定义为疾病变得异常的生物标志物。接下来,通过结合个体特定事件排序,获得了显示概率 Kendall 的 tau 距离到个体特定顺序的最小总和的中心排序。此外,还建立了事件中心,以获取事件之间的相对距离和位置。疾病进展的时间表是通过结合中央排序和事件中心来确定的。采用100次重复的Bootstrap重采样来评估事件中心排序和方差的不确定性。
然后,该研究使用 10 倍交叉验证来验证 DEBM。从0期到1期,为每个受试者(包括PD患者和HC)分配了一个疾病分期。所有受试者的疾病分期主要由他们的个人生物标志物谱和他们在疾病进展时间表上的位置决定,而不是由临床诊断决定。计算曲线下面积 (AUC) 以区分 PD 组和 HC 组。该研究通过计算估计的疾病分期与帕金森病患者帕金森病临床症状之间的关联来进一步验证了该模型。
3. 结果
3.1 研究对象特征
该研究的研究对象总共包括 374 名 PD 患者和 169 名 HC。参与者的特征如表1所示。PD患者在性别(p = 0.65)、年龄(p = 0.17)或ESS评分(p = 0.95)方面无显著差异。
3.2 生物标志物变化的顺序
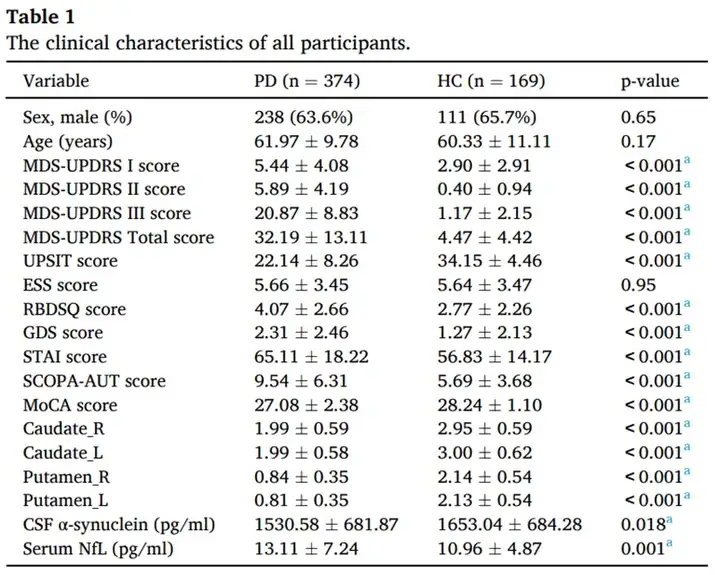
DEBM估计的生物标志物变化的中心顺序和该模型的不确定性显示在位置方差图中(图1A)。根据临床知识,该研究显示,左壳核是所选生物标志物中最早的异常生物标志物,其次是右壳核、脑脊液α-突触核蛋白、右尾状核、左尾状核和血清NfL。该模型的不确定性相对较小,表明本研究估计的顺序是可靠的。事件中心如图1B所示,其中左壳核和右壳核的事件中心彼此靠近,左尾状核和右尾状核也是如此。然而,脑脊液α-突触核蛋白和血清NfL的事件中心与其他事件中心分开。预估事件中心的方差与PD组和HC组之间生物标志物分布的差异相关。具有较低 p 值的生物标志物(表 1)在估计事件中心中的方差较小。
图1(A)PD中生物标志物变化顺序的位置方差图。
y 轴表示生物标志物变化的顺序(从上到下)。顶部的生物标志物是最早的事件,底部的生物标志物是最晚的事件。位置方差图中每个方块的颜色强度表示自举重采样迭代中位于特定位置的生物标志物的频率。生物标志物排序显示了通过拟合所有参与者获得的顺序。(B)事件中心方差图。它显示了生物标志物估计事件中心的标准误差。所有过程均通过重复 100 次的自举重采样进行测量。
3.3 验证
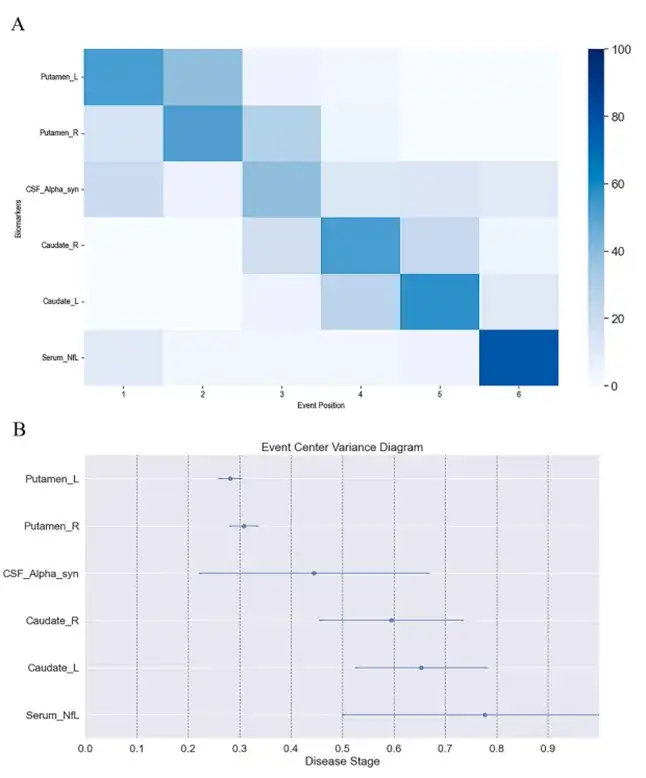
PD 和 HC 的估计疾病分期和分布总结在图 2 中,其中 PD 和 HC 的疾病分期分布充分分离,并从 HC 增加到 PD。该分布在0期出现峰值,主要由HC组成。HC 主要被分配到早期阶段。所有HC的分期均不高于0.6期,而PD患者集中在中晚期。鉴别PD与HC的估计疾病分期的AUC为0.98(95%置信区间(CI)0.97–0.99,p < 0.001),敏感性和特异性分别为0.95和0.92。这意味着估计的疾病分期在区分 PD 患者和 HC 方面是稳健的。
图2所有参与者的估计疾病分期。
上图:直方图显示了 PD 和 HC 不同疾病阶段的分布。下图:箱线图显示了 PD 和 HC 不同疾病分期的分布。
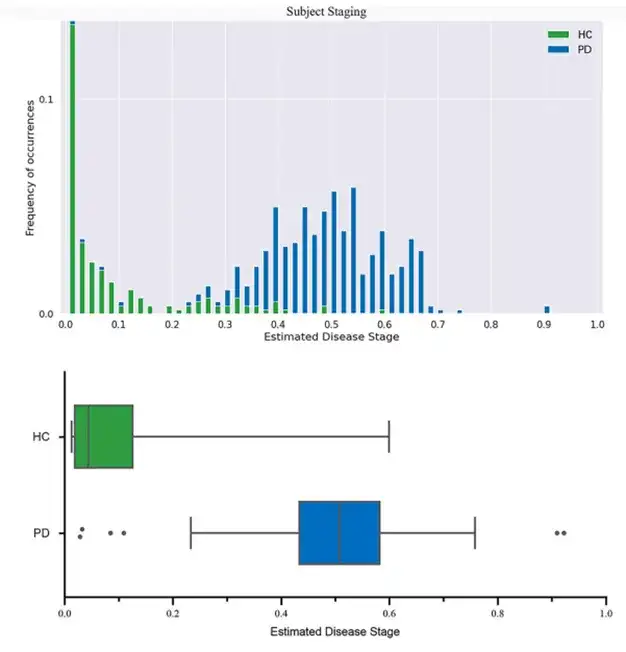
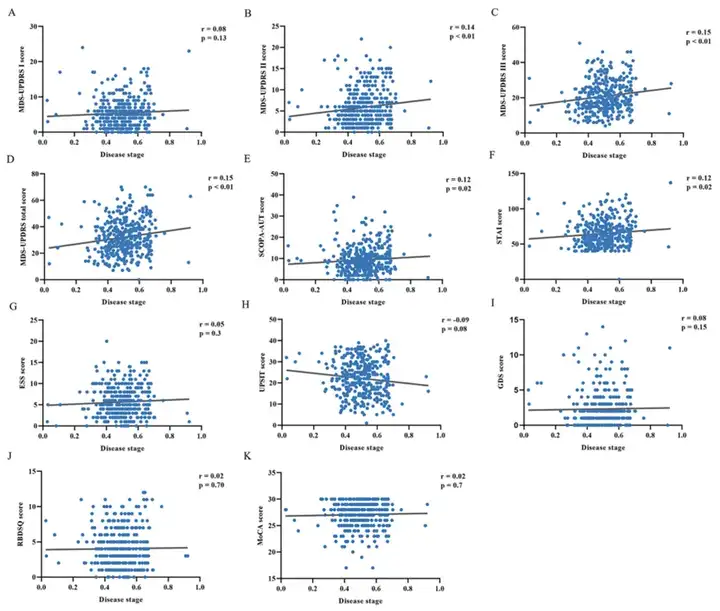
图3 PD患者估计的疾病分期与疾病严重程度之间的关联。
(A) MDS-UPDRS I 评分(B) MDS-UPDRS II 评分(C)MDS-UPDRS III 评分(D) MDS-UPDRS总分(E) SCOPA-AUT评分(F) STAI 评分(G) ESS评分(H) UPSIT 评分(I) GDS评分(J) RBDSQ 评分(K) MoCA 评分
4. 讨论
该研究首先应用了一种有前途的数据驱动方法(DEBM)来评估PD中几种常见生物标志物变化的顺序,包括DAT成像、脑脊液α-突触核蛋白和血清NfL。该研究的数据驱动的 DEBM 分析表明,左侧壳核是这些生物标志物中最早出现异常的生物标志物,其次是右侧壳核、脑脊液α-突触核蛋白、右侧尾状核、左侧尾状核和血清 NfL。此外,通过患者分期确定的预估疾病分期在区分 PD 患者和 HC 方面具有极好的准确性,并且与 PD 患者的疾病严重程度相关。
大量证据证实,黑质纹状体功能障碍主要出现在帕金森病的临床前阶段,当患者被诊断为帕金森病时,黑质中大约一半的神经元退化。一项研究表明,纹状体多巴胺能神经元的变性在运动症状出现前 14.4 年开始。该过程最初发生在后背壳核,然后扩散到后腹侧和前壳核,最终累及尾状核 。另一项研究发现,壳核中多巴胺功能障碍的症状前期长达 17 年,尤其是在年轻的 PD 患者中,可超过 20 年。壳核是该模型中最早变得异常的生物标志物,这支持了先前的发现,即壳核总是最先对黑质纹状体多巴胺系统造成损害。此外,该研究发现左壳核的多巴胺能恶化发生在右壳核之前。继发于对侧半球黑质纹状体变性的单侧运动症状是帕金森病的临床特征。在该研究中,55.6% 的 PD 患者在症状发作时主要右侧受累,42.5% 的患者左侧受累。同时,从这项研究可以看出,左壳核SBR相对低于右壳核SBR,这表明左壳核的退化比右壳核更严重。因此,该研究假设 PD 发作时受影响最大的一侧和双侧壳核之间不同程度的神经元变性可以解释左侧壳核在右侧壳核之前出现的原因。
在这项研究中,数据和模型表明尾状变性发生的时间相对较晚于壳核变性和脑脊液α-突触核蛋白减少。这一结果为先前研究提供了数据驱动的支持,这些研究表明,尾状核中的多巴胺能系统在帕金森病发作时相对完整。应该注意的是,在该研究的模型中,右尾状核功能障碍先于左尾状核功能障碍。在该研究中,左尾状核 SBR 几乎等于右侧尾状核 SBR。图1B表示右尾状由于 SBR 几乎相似且位置接近,DEBM 的不确定性可能导致右侧尾状体的位置早于左侧尾状体的位置。因此,需要更大的样本量或纵向队列来验证这些结果。
异常的α-突触核蛋白沉积是帕金森病病理学的标志,与多种神经退行性疾病有关。在帕金森病患者中,脑脊液中α-突触核蛋白水平降低,即使在前驱期帕金森病和早期帕金森病中也是如此。几项研究表明,脑脊液中的 α-突触核蛋白水平可能在 PD 发作前开始下降 。人们普遍认为,中枢和周围神经系统中异常的α-突触核蛋白聚集发生在帕金森病典型运动症状发作前几年。根据 Braak 分期,α-突触核蛋白沉积物最初出现在肠丛和嗅球中,然后逐渐扩散到蓝斑、黑质、Meynert 基底核、杏仁核,最后扩散到新皮层。然而,尚无有效的方法来确定哪些个体表现出α突触核蛋白病理学,也不清楚α突触核蛋白如何释放到脑脊液中,以及脑脊液α突触核蛋白何时变得异常。该研究的研究结果显示,脑脊液α突触核蛋白异常出现得相对较早,但比壳核变性晚。这项研究似乎与Braak分期略有不同。然而,目前尚不清楚脑脊液中α-突触核蛋白的变化是否与Braak分期中描述的α突触核蛋白的沉积一致。因此,开发和应用一种高度灵敏的检测方法,在PD的早期阶段检测α-突触核蛋白的变化,以验证当前的资金至关重要。
本研究中血清 NfL 的晚期出现可能与之前两项研究的结果形成某种对比。一项研究表明,血清中的个体内 NfL 在表型转换期间增加,即从前驱期到临床确定的 PD。然而,他们未能检测到个体的NfL绝对水平与年龄匹配的对照组之间存在任何显着差异。另一项研究表明,前驱期帕金森病患者和无症状帕金森病相关基因突变携带者的血清 NfL 水平高于对照组,但随着时间的推移保持稳定。然而,在帕金森病的早期阶段,广泛而严重的轴突损伤并不明显,这与快速进展的非典型帕金森病的轴突变性程度相反。先前的研究表明,PD 患者在发病数年后测量的 NfL 水平升高。该研究的模型估计,纳入的生物标志物中的最后一个事件是血清中NfL的增加。然而,在位置方差图中,几个增加的血清 NfL 分布在事件的早期位置(图 1A)。这可能表明本研究中个体之间存在异质性和差异。也就是说,一些参与者早期出现血清NfL变化,但其他参与者则较晚发生事件。遗憾的是,由于样本量相对较小,该研究没有研究脑脊液中的NfL。然而,血液NfL与CSF NfL密切相关,被认为是PD诊断和进展的潜在生物标志物。
该研究使用 10 倍交叉验证来验证 DEBM。值得注意的是,该研究观察到几乎所有的HC都处于较低的疾病阶段,而PD患者则处于较高的疾病阶段。然而,较少的PD患者被分配到0.8以上的疾病分期,并且疾病分期与临床严重程度之间的相关性较弱。结果可能归因于参加本研究的 PD 患者的特征。该研究中的所有帕金森病患者病程较短,与病程较长的患者相比,生物标志物异常不那么严重。这可能导致估计的疾病分期被低估。此外,疾病分期仅与一些临床症状相关,主要是运动症状,与大多数非运动症状无关。这可能是因为,相对于非运动症状,运动障碍是早期初治药物治疗患者中最常见和最主要的症状。因此,需要在纵向队列中复制该研究的发现。
本研究的优势在于,该研究首先应用了一种可靠的方法,DEBM,来获得帕金森病中几种常见生物标志物的时间轨迹。然而,这项研究有一些局限性。首先,该研究纳入了PPMI中的PD患者,这些患者主要由基线时的早期初治PD患者组成,估计的疾病分期与临床严重程度之间的关联较弱。未来,希望招募具有不同疾病分期的患者,甚至是前驱期 PD,以推断 PD 整个病程的病理变化。其次,在这项研究中,该研究只选择了六种常见的帕金森病生物标志物。因此,在未来的研究中研究更多涉及各种PD病理的生物标志物非常重要。第三,该研究的研究中还应提及早期初治药物PD患者误诊的可能性。然而,PPMI 中的 PD 患者在入组时临床诊断为特发性 PD (iPD) 和 SPECT 上的突触前多巴胺能终末缺陷。此外,对PPMI患者进行随访,并在每次就诊时记录其诊断情况。为避免误诊,该研究对诊断进行了纵向评价,不包括将主要诊断从基线改为随访的患者。最后,结果基于一项横断面研究,未在纵向或外部队列中得到验证。通过纵向或外部队列验证该研究的结果至关重要。
总之,该研究使用一种有前途的数据驱动方法 DEBM 探索了 PD 中几种常见生物标志物变化的顺序。该研究的结果表明,左壳核是所包含的生物标志物中最早发生变化的生物标志物。有必要使用纵向和外部数据进一步确认和验证该研究的研究结果,以便为本研究的可靠性和普遍性提供证据。