Revvity小动物活体光学成像技术已在生命科学基础研究、临床前医学研究及药物 研发等领域得到广泛应用,其中纳米材料研究是该技术的重要应用方向之一近年来, 纳米材料在生物医学研究以及药物研发过程中表现出极大的应用潜能,吸引了生物学 ,医学,材料学等众多交叉领域研究人员的关注。在小动物活体技术主要应用到以下领 域当中:1、纳米探针的研发;2、纳米药物载体评价;3、纳米材料生物相容性和安全 性评价。下面结合一些具体的实例进行阐述:
一.纳米探针的研发 纳米荧光探针作为一种新型的探针,它所特有的量子尺寸效应和小尺寸效应使其呈 现出特有的光学性质。与传统的有机荧光染料相比,纳米荧光探针具有较好的激发及发射 特性,可通过调整探针的大小和组成来进行控制,从而调整到用于小动物活体光学成像 的光学波段;同时,荧光强度高,稳定性强,寿命长以及生物相容性好等优点,使得纳 米荧光探针在对病灶以及靶标的标记以及生物体内代谢分布研究中呈现出天然的优势。
目前基于小动物活体成像技术开发探针的研究中,根据荧光纳米材料不同主要包括 以下几类:量子点,金属纳米粒子,上转化纳米材料,半导体聚合物纳米材料等。下面 以量子点,上转化材料以及半导体聚合物纳米材料开发的探针为例子介绍小动物活体成 像技术的应用。
1.量子点
量子点是一种由元素周期表中Ⅱ-Ⅵ主族如CdSe,CdTe,Ⅲ-Ⅴ主族如InP,InAs等组 成的纳米颗粒,直径在1-100nm之间,能够接受激发光产生荧光的半导体纳米颗粒。量 子点的体积大小严格控制着它的光谱特征。量子点由于其量子尺寸效应,粒径不同或组 成材料不同可发射不同颜色的荧光。该探针具有以下显著特点:发射光谱窄,光谱重叠 明显减小,该特性适合作为基于荧光共振能量转移荧光探针的供体,相比较下,有机荧 光染料宽发射光谱带来的红端拖尾效应会造成供体受体发射光的重叠串扰;具有宽广的 激发带,而发射波长可以通过调整粒子径的大小进行调节,有利于开展生物样品多色标 记;具有较高的量子产率,较大的stokes位移,优良的稳定性以及抗光漂白能力。
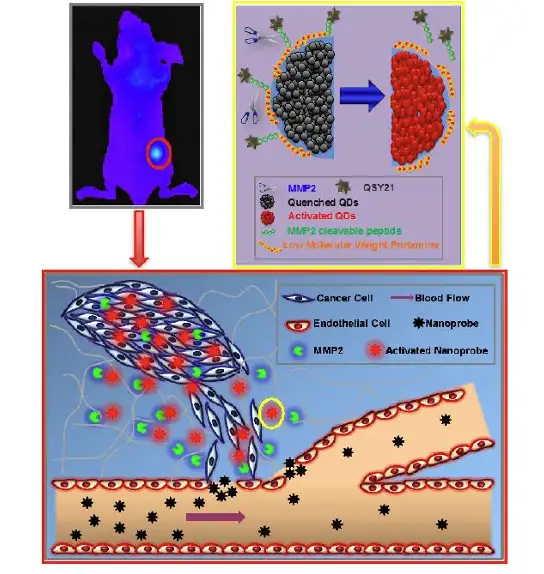
Yaping Wang 等开发了一种MMP-2敏感性的纳米探针,用以检测MMP-2过表达的 肿瘤(Theranostics. 2015)。MMP-2(基质金属蛋白酶-2)在大部分的实体瘤中都有检 测到过量表达,比如乳腺癌,结肠癌,前列腺癌等。由于MMP-2在促进癌症发展过程 中发挥重要作用,因此,它可以作为肿瘤诊断和治疗的重要靶点。而该探针的原理是将 染料DSY21以及量子点通过MMP2的底物肽段(MMP2-cleavable peptide)连接,此时由于二者接近,FRET效应会抑制量子点产生荧光信号,而当探针进入MMP高表达的 相关肿瘤位点时,MMP2就会水解荧光基团之间的肽段,就会释放出可以激发的功能性 量子点,已达到对MMP2的检测(图1)。
图1: MMP-2活性纳米探针示意图
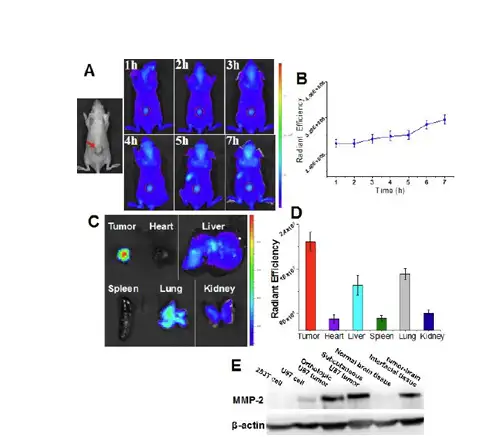
利用小动物光学活体成像技术,监测人纤维瘤细胞HT1080皮下瘤小鼠,人乳腺癌 细胞MCF7 皮下瘤小鼠,人胶质瘤细胞U87皮下瘤小鼠体内该纳米探针在肿瘤部位以 及各器官中的分布情况。以皮下脑胶质瘤模型为例,U87体外培养细胞系的MMP-2表 达含量很低,但是在皮下瘤模型以及原位肿瘤中组织MMP-2含量却很高(图2E),表 明肿瘤细胞在体内形成会收到肿瘤环境的影响。将皮下异质瘤模型纳米探针在1h后开 始聚集到肿瘤部位,并且荧光信号在随后6h过程中逐渐升高(图2A,2B)。24h后离 体检测各主要器官以及U87肿瘤组织中的荧光强度(图2C,2D)。结果显示,在肿瘤 组织中检测到荧光强度是最高的,表明该探针用于活体内肿瘤的检测。
图2:皮下脑胶质瘤模型活性中纳米探针体内分布以及各器官分布情况以及MMP-2在各细胞系以及组织的表达情况
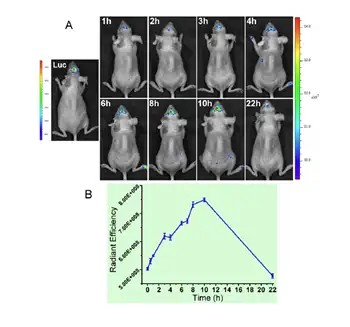
然而,脑肿瘤检测一个重要的方面是要考虑探针跨越血脑屏障的能力,因此,本工 作又构建了原位胶质瘤小鼠模型。为了对肿瘤形成进行检测,通过Luc标记的U87细 胞进行模型构建(图3A左侧)。在该探针上整合T7序列(脑靶向序列),用以提高 该探针在脑肿瘤部位的积累。结果显示T7功能纳米探针在1小时后在肿瘤部位开始积 累,并且荧光强度在10小时内逐步增强,并在22小时后逐渐消逝(图3)。
图3:原位脑胶质瘤模型活性中纳米探针体内分布的表达情况
量子点包含镉或其他重金属,即使在很低的浓度下还是有很强的毒性。因此,在开 发用于活体成像的量子点探针时,如何降低量子点的毒性也是主要考虑的问题之一。目 前新的替代产物也在逐步的开发出来,其中碳纳米点,石墨烯纳米点等低毒性纳米材料 已经用于活体检测当中。而且,量子点需要高能量的紫外或近紫外光激发,在采集荧光 探针信号的同时,生物组织在高能量光源激发下产生的自身荧光也会极大干扰荧光探针 的信号,造成信噪比变差,从而不能检测深层生物组织的信号。
2.上转化纳米材料
稀土离子上转换发光材料是一种在近红外光激发下能发出可见光的发光材料,即可 通过多光子机制把长波辐射转换成短波辐射,所以称之为“上转换”。其最大的特点是 材料所吸收的光子能量低于发射的光子能量。
荧光上转换纳米粒子吸收两个或两个以上的红外光子,发射一个可见光子或近红外 光子。通过改变掺杂离子度,可以实现从紫光到近红外的发光调控。与量子点和有机荧 光染料相比,荧光上转换纳米材料具有化学稳定性好、荧光量子产率高、毒性低、不会 产生背景荧光、信噪比好等特点。最重要的是,荧光上转换纳米粒子的激发光为红外光 (常用808nm,980nm),这个波段的光在生物组织和血液中的吸收极低,是人体的透明窗口,因此可以用于检测更深层的生物组织情况,且不会对生物组织产生光损伤。此 外,红外激光器小巧紧凑、功率高、价格低廉,为荧光上转换纳米粒子的实际应用提供 了良好的条件。以上这些优点使得荧光上转换纳米粒子在生物分析,特别是在生物体内 成像上有着广阔的应用前景。
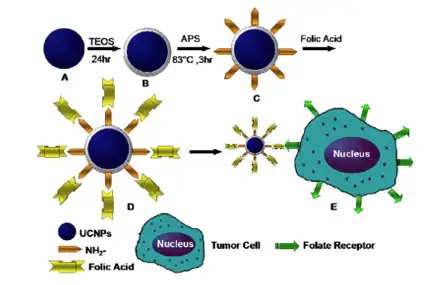
Liyuan Pan 报道了小尺寸、高荧光信号强度的上转化纳米探针,用来对活体内胃肿瘤进 行靶向标记(Theranostics.2013)。如图 4,首先通过反应以 SiO2 纳米材料包裹上转化材 料NaYbF4: 25%Gd, 2%Tm ,用以增加该材料的组织相容性;之后,通过氨基官能团将叶酸 FA 连接到材料上,从而合成用于特异性识别叶酸受体的纳米探针。
图4:上转化纳米探针UCNP-FA合成示意图
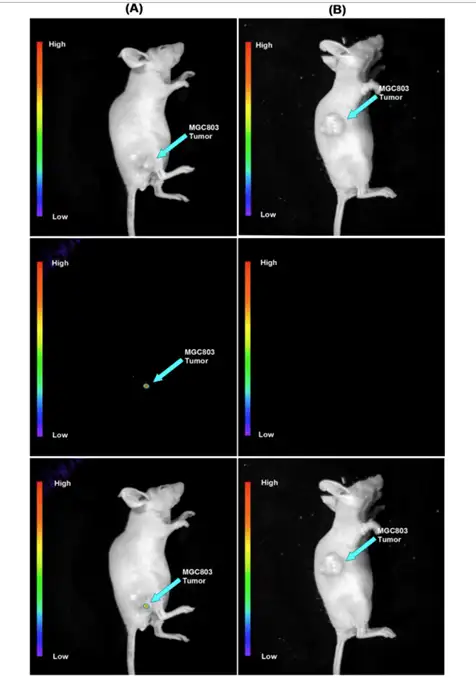
叶酸受体(Folate Recetor)是一种细胞膜上的糖蛋白,在正常情况下只在胎盘组织, 肾小管等中有少量表达,但是在许多恶性肿瘤中,受体的表达数量以及活性都远远超过 正常水平。因此,可以将它作为肿瘤的标志物。通过小动物活体成像技术可以检测该纳 米探针对胃癌的靶向作用。首先裸鼠皮下接种胃癌细胞MGC803,待到肿瘤组织生长到 5mm 后,尾静脉注射UCNP-FA荧光探针(图5A),并同时注射未连接FA的材料作 为对照(图5B)。然后,通过外接激光器进行激发,并利用小动物活体设备进行检测。 结果发现,UCNP-FA荧光探针具有很好的生物学靶向作用。
图5:皮下MGC803瘤小鼠荧光成像,分别通过尾静脉注射 NaYbF4: 25%Gd, 2%Tm-FA (A) 以及 NaYbF425%Gd, 2%Tm @SiO2-NH2:
在上转化材料用于活体成像研究中,由于涉及到外置激光器,因此,仪器整合的同 步性,安全性方面都是研究过程中需要考量的重要因素。
3.复合型纳米探
有机半导体聚合物是一类因共轭电子而产生半导体性质的高分子材料,在高灵敏的 化学和生物传感器领域获得了广泛应用 。半导体聚合物具有光学吸收截面大、荧光量 子效率高、辐射跃迁速率快等特性,这些优异的光学性质特别适合于开发生物应用方面的 纳米荧光探针。这些小尺寸高亮度的纳米材料可以通过表面功能化与生物分子偶联,从而 在生物医学应用中发挥重要作用。
Shuhendler 等报道了一种纳米探针,可以实时的同时监测小鼠肝内部的活性氧 (ROS)以及活性氮(RNS),从而对药物的急性肝毒性进行评价(Nat Biotechnol. 2014)。 药物毒性是现代药物研发过程存在已久的问题,而其中药物导致的肝毒性是影响药物上 市的一个最重要的因素。因此,在临床前实现对药物肝毒性的监测,能够在药物研发的 初期尽量降低肝毒性,大大提高药物研发的成功性并且降低研发成本。ROS 以及 RNS 可以作为药物安全性评价的标志物:ROS(包括 H2O2)可以通过药物代谢过程中的 I 型氧化酶直接产生,或者间接通过自由基药物代谢产物与氧发生反应产生;药物代谢过程 中,电子传递链的断裂会造成线粒体毒性,进而导致RNS的产生。由于ROS以及RNS生 成来源不同,对它们的同时监测能够更加全面地反映肝毒性机制,从而可以对药物的毒性作 出更加精确的评价。
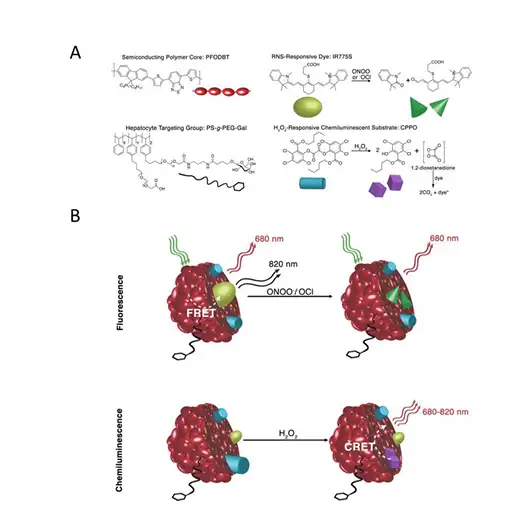
这种探针将两种探测元件整合到半导体聚合物纳米荧光材料上(CPN)(图6A): H2O2敏感的化学发光底物通过化学发光共振能量转移(CRET)导致CPN发光,该模式 不需要外源光的激发;另外,激发 CPN 材料通过荧光共振能量转移至可氧化降解的荧 光染料,并通过发生共振转移的荧光比率来对ONOO−进行检测,该模式需要外源光的 激发。这种将 CRET 以及 FRET 整合到 SPN 上的这种探针称为 CRET-FRET-SPN (CF-SPN),该探针中纳米材料CPN在CRET中作为光受体,而在FRET中则作为光供 体(图6B)。另外,在 CF-SPN 上连接了乳糖残基,会靶向性的结合到肝细胞窦状隙 膜上表达的非唾液酸糖蛋白受体,以实现该探针对肝器官的定位(图6A)。通过IVIS 的生物发光以及荧光成像功能,可以为该探针的两种检测模式提供完善的监测解决方案。
图6:ROS以及RNS检测探针的CF-SPN的模式图。A.CF-SPN组成的分子部件:PFODBT,近红外荧光半导体聚合物;IR775S,通过ONOO−或−OCl氧化会发生降解;PS-g-PEG-Gal,通过galactose residues树脂连接半乳糖残基,用于定位肝组织;CPPO,H2O2特异性的化学发光底物 B. 通过荧光以及化学发光分别监测RNS以及ROS
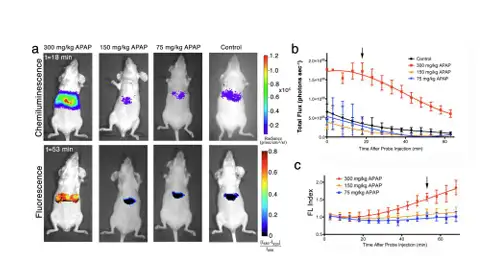
为了验证 CF-SPN 的效果,我们利用退烧药 APAP 诱导的肝毒性模型进行检测。 APAP 诱导肝毒性的机制已经研究的很清楚了,主要是由于I型药物毒性代谢途径。过 量的APAP诱导生成过量的ROS以及RNS,从而产生氧化和氮化压力。随后,关键的 细胞抗氧化剂GSH的消耗会启动一系列的信号反应,导致细胞的坏死。通过尾静脉注 射APAP,15min后注射CF-SPNs后即时进行持续的生物发光以及荧光图像采集(图7A)。 结果显示,18min的化学发光图显示在一个APAP过量剂量(300 mg/kg)的情况下,光信 号有一个显著的增强过程;然而在低剂量(75,150 mg/kg)情况下,光信号的强度与对照 组的强度相近(图 7B)。这种阈值剂量型的毒性特性(比如,低于关键毒性剂量的剂 量非依赖性特征)与APAP诱导肝毒性的机理是一致的。荧光图片结果显示出与生物发 光类似的阈值剂量型毒性,不过这种信号在53min后才显示出了明显的差异性(图7C)。 这个结果说明了APAP过量诱导的ONOO−生成要晚于H2O2的产生。
图7:实时活体成像监测APAP注射小鼠的肝毒性
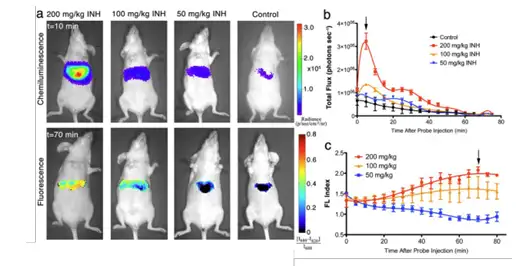
之后,根据以上模型的结果,又利用CF-SPN检测了另外一种广泛使用的化疗药物 INH 诱导的肝氧化和氮化压力。INH在3%-13%的病人中表现出了肝毒性,但是相关的 机制还不是很清楚。通过尾静脉注射INH,15min后注射CF-SPNs后即时进行持续的生 物发光以及荧光图像采集。结果显示,与APAP阈值型毒性不同,INH在H2O2的产生 上表现出阈值剂量型,而在ONOO− 的产生中表现出剂量依赖型。而且,氧化压力以及 氮化压力的动力也显著的不一样。INH诱导了更加快速短暂的氧化激增,之后会快速的 回复;而诱导的氮化压力表现出缓慢且持续的增长(图8)。
图8:实时活体成像监测APAP注射小鼠的肝毒性
因此,这种利用CF-SPN对药物肝毒性诱导的氧化和氮化压力的持续监测,可以使 用于各种类型的药物生物反应机制,并且可以通过不同的动力学表现特征将它们区分开 来。而要实现这一检测的前提,除了纳米探针的巧妙设计之外,还需要小动物活体光学 成像技术的支持。不仅能够实现高品质生物发光以及荧光的检测,同时,可以对小动物 进行连续持续的动力学检测。
另外,除了以上基于本身有荧光特性的纳米探针之外,利用能够装载有机荧光染料 的纳米载药系统也可以作为纳米探针进行使用。而这种改造大大提高了原有机荧光染料的稳定性,持续性以及光学特性。这一部分工作在以下纳米药物载体部分进行相应阐述。
二.纳米药物载体研究 纳米药物载体已经成为国内外医药学研究的重要领域。纳米载药系统相对于传统药 物展现出巨大的优势:首先,纳米载药系统可以通过连接的特异性化合物,多肽,抗体 等基团提高药物的靶向性;其次,纳米药物载体可以通过细胞内吞等机制而非跨膜转运 机制进入细胞,大大提高了药物生物膜的透过性,从而提高细胞内有效的药物浓度;再 次,药物靶向性的提高以及生物膜通透性的增强,就相对降低了非有效作用部位药物的 浓度,药物的毒副作用相应会降低;另外,纳米缓释特性以及高度分散性,也提高药物 的时效性以及利用率。
应用小动物活体成像技术对纳米药物载体的研究,主要是对纳米药物载体在小动物 体内分布特性以及靶向性评价,用以评价药效的提高以及毒副作用。该技术可以通过两 个方面来研究纳米载药系统:通过对疾病细胞进行荧光或者生物发光标记,观测纳米药 物载体对药物药效的提高;通过直接对纳米载药系统进行荧光标记,观测纳米药物载体 在动物体内分布以及定位情况。下面我们以纳米药物载体提高阿霉素Doxorubicin 对肿 瘤的药效以及靶向性研究为例对这两种方式进行阐述。
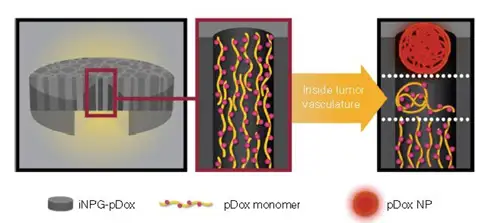
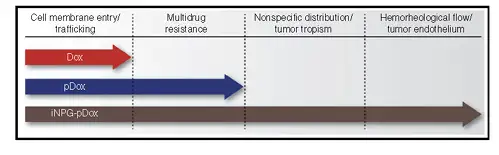
Rong Xu 等开发了一种可注射纳米粒子发生器,能够在小鼠的肺转移瘤内生成纳米 粒子,从而治疗肺转移性肿瘤(Nat Biotechnol.2016)。该研究从突破体内生物屏障角 度出发,创新性构建了新型纳米药物iNPG-pDox。与传统化疗药物阿霉素仅能穿透细胞 膜单一生物屏障相比,独特的设计使 iNPG-pDox 能突破体内多种生物屏障,高效靶向 乳腺癌的肺转移瘤。
图9:新纳米药物 iNPG-pDox模式图, pDox前体药物装配, pDox 纳米材料装配释放
该纳米药物iNPG-pDox由装配多链聚合物(pDOX)的纳米多孔硅材料组成,而每 条单体链都含有阿霉素。一旦进入肿瘤,硅材料就会降解,释放出单体链。由于自然动 力学力量,这些链就会形成可以被癌细胞吸收的纳米粒子(pDOX NP),被内吞进入细 胞核周酸性区域。聚合物上链接阿霉素的PH值敏感的连接基团断开,释放出阿霉素,从而大大提高药物进入细胞的浓度(图9)。纳米药物的每个部件在突破不同生物学屏 障过程中发挥不同的作用(图10)。
图10:iNPG-pDox独立部件在突破系统屏障过程中发挥的作用
图11:肺部MDA-MB-231肿瘤转移的生物发光检测。
为了观察纳米药物对肺转移肿瘤的效果,利用生物发光标记的转移性 MDA-MB-231 细胞构建肺转移模型,从而比较纳米药物相对于相同量传统药物对癌细 胞肺转移的抑制情况。结果显示,纳米药物iNPG-pDoX相对于传统的DOX来说展现出 更好的治疗效果(图11)。
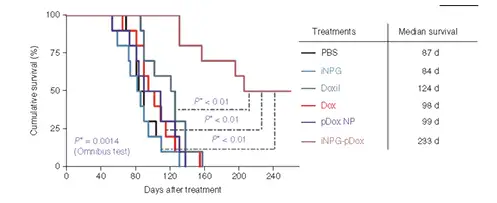
图12:不同给药组小动物生存曲线及相应数据
之后的生存数据进一步验证了这一结果,在接受该药物治疗的小鼠当中,有50%的 小鼠在八个月后没有出现转移性疾病的迹象(图12)。这相当于人类转移性疾病约24 年的远期生存。这种新的药物可以帮助医生治疗其他来源的肺转移癌,以及原发性肺癌。
小动物活体成像技术保证了对疾病模型小鼠长达8个多月的持续性检测,极大的降低了实验成本,提高了实验的准确性。反映了纳米药物载体相对于传统药物在靶向作用 以及疗效上展现出了巨大的优势。除此之外,利用荧光标记药物则可以对纳米药物载体 进行示踪,从而更加直观的观测靶向作用以及生物体内分布情况。
Hai Wang 等则在纳米药物载体上连接了荧光染料,从而可以对这一治疗性纳米药 物进行监测(Nat Commun. 2015)。他们开发了一种强大的仿真核细胞纳米载药系统用 以装配治疗和诊断试剂,从而精确的控制药物的运输。
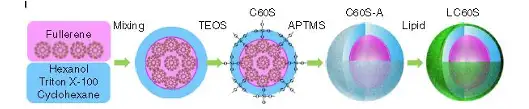
图13:LC60S 纳米载药系统合成示意图
该仿真核细胞载药系统LC60S 由富勒烯(C60),介孔氧化硅以及磷脂(DPPC) 组成,具有很好的真核细胞结构,包括磷脂膜(DPPC),细胞骨架(介孔氧化硅)和 细胞核(C60)(图13)。
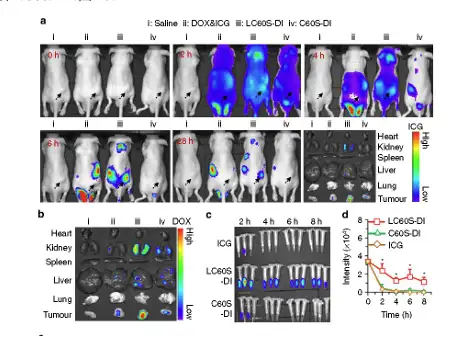
图14:a,活体内 ICG 标记药物载体体内分布;b,药物在离体器官以及肿瘤中的分布;c,d,药物在血液中含量
利用该载药系统可以同时装载ICG以及DOX,从而实现对肿瘤的靶向治疗以及对 该纳米材料实时监测的双重功能。结果显示,在注射后2h,三种含有ICG成分药物注 射的小鼠全身都可以检测到ICG荧光。然而,重要的是在只有LC60S-DI组小鼠的肿瘤 区域观测到较强的荧光,而且该荧光强度在4-6小时后逐渐增强;而与之相反,DOX&ICG 或 C60S-DI 组小鼠的肿瘤区域则没有 ICG 荧光信号。并且,28 小时后仍然可以在 LC60S-DI 组小鼠中监测到ICG荧光(图14a)。为了进一步验证,28小时后将各个器官以及肿瘤进行离体荧光检测,同样显示只有LC60S-DI的肿瘤中检测到极强的荧光(图 14b)。通过对血液中ICG荧光进行检测发现:游离ICG快速从血液循环中消逝,2小 时以后荧光强度下降70%;血液中C60S-DI的代谢速度也是一样。而与之相反,LC60S-DI 纳米材料血液中仍然可以检测到很强的荧光强度,而且在8小时以后的荧光强度也在初 始的一半以上(图 14c,d)。这些结果表面, LC60S-DI 纳米材料在体内有更长的半 衰期,并具有更加符合药物传输的纳米材料特性。
该工作充分体现了小动物活体成像技术的优势,不仅可以对活体进行实时观测,还 可以对离体器官以及血液体液中药物浓度进行检测。从而,实现对纳米药物的多方面研 究需求。而该技术在对纳米药物载体示踪研究中已经极为成熟。
Changying Shi 等也做了类似的工作(Nat Commun. 2016),利用线性分枝状聚合 物构建纳米药物载体,并利用该载体装载的 DOX-2nd GNP 相对于 Dox 以及 Doxil® (DOX脂质体)对淋巴瘤具有更好的治疗效果(图15)。
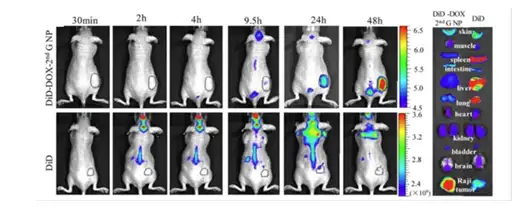
图15:游离DiD远红外荧光染料以及DiD-DOX-2nd GNP在Raji淋巴瘤小鼠活体和离体器官的荧光强度
三.纳米材料生物相容性和安全性评价
与其他应用于生物学活体研究一样,纳米材料进入机体,穿过生理性屏障以及靶向 特定部位的这些过程都与材料的生物相容性密切相关。不管是在纳米探针开发还是在纳 米药物载体的构建过程中,组织相容性都是需要考虑的重要方面。以前文为例,量子点 探针中的LMWP,上转化探针中SiO2纳米材料,纳米药物iNPG-pDox中的聚合物以及 LC60S 纳米载药系统的类真核细胞设计都是纳米材料生物相容性考虑的直接体现。因 此,这里就不再进行赘述.
而所有纳米材料作为活体研究工具,都需要进行安全性评价,其中肝毒性评价实验 通常被用来进行材料以及药物毒性评价。下面以军事医学科学院的研究为例,Zhang Y 等构建了肝脏急性炎症反应模型,可以用来评价纳米材料的肝毒性(Small.2016)。
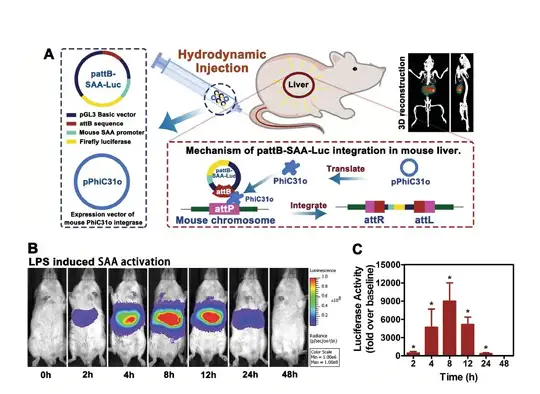
图16:肝脏SAA长期稳定表达模型示意图以及活体检测结果
纳米金作为一种常见的高组织相容性纳米材料,广泛应用于疾病的诊断和治疗当 中。最近越来越多的研究表明,纳米金注射到动物体内以后,会在肝脏和脾脏中积累。 而在这些免疫细胞富集的区域,这种积累会造成一系列的局部或者全身炎症反应。急性 期蛋白SAA主要分布于肝细胞中,在急性炎症反应中表达量水平上升了1000倍,因此 可以作为急性炎症反应模型。通过水动力高压转染并且结合噬菌体整合技术建立肝脏 SAA长期稳定表达模型,可以对肝脏SAA进行连续、动态、实时监测,并用LPS进行 验证(图16)。
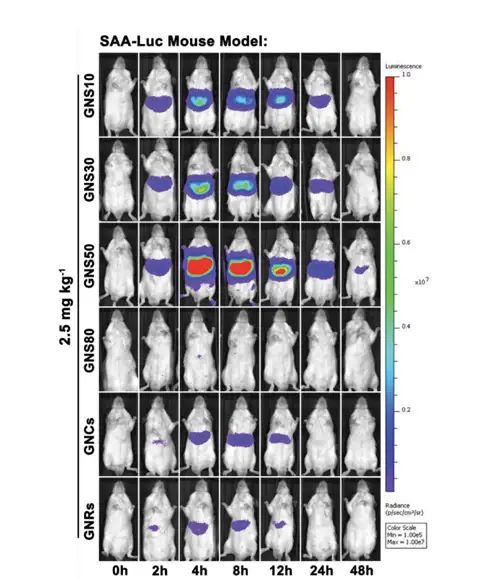
图17:不同尺寸形状的纳米金激活肝脏SAA的情况
应用该模型发现纳米金因形貌和粒径的不同激活SAA表达程度的差异。以4~6周 龄雄性Balb/c 小鼠为模型,尾静脉注射 GNP10,GNP30,GNP50,GNP80(不同纳米 尺寸),GNRs,GNCs等6种纳米金材料,分别在注射材料前,注射后4h/8h/12h/24h/48h 进行活体生物发光检测成像监测。结果发现,GNP50球形金颗粒会激起机体最强的急性 炎症反应(图17)。
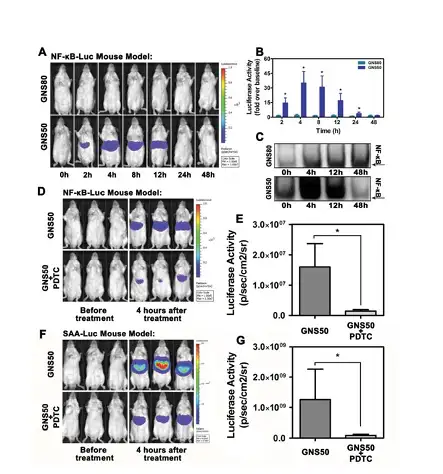
图18:纳米金激活肝脏SAA的过程依赖于NF-κB通路
为了研究该激活途径的具体机制,用类似的NF-κB模型小鼠进行研究。结果表明 GNP50 能够激活NF-κB通路,这种激活过程可以被NF-κB抑制剂PDTC所阻断。进 一步发现GNP50 诱导SAA激活的过程可以被PDTC所抑制,证明该效应是通过NF κB通路激活的(图18)。
四.总结
纳米材料的研究已经越来越频繁的使用小动物活体成像技术。它在各种类型的荧 光,化学发光探针的检测方面展现出了极大的兼容性;同时,对于纳米药物载体的评价 以及毒性的评价方面也表现出极大优势。今后,随着纳米技术与生物医学研究的进一步 融合,小动物活体成像必将在这一领域发挥越来越重要的作用。