Revvity小动物活体光学成像技术已在生命科学基础研究、临床前医学研究及药物研发等领域 得到广泛应用。在众多应用领域中,肿瘤免疫治疗已经成为活体光学成像技术的热点之一。肿瘤免疫 治疗被称为继手术、放疗、化疗后第四种疗法;与传统治疗方式不同,免疫疗法是激发或调动机体的 免疫系统,增强肿瘤微环境的抗肿瘤免疫力,从而控制和杀伤肿瘤细胞,是疗法是当前肿瘤治疗领域 最具前景的研究方向之一。因为近几年在临床实验上取得的巨大成功,肿瘤免疫疗法被Science杂志评 为2013年十大科学突破第一位,目前肿瘤免疫疗法策略主要包括肿瘤疫苗、细胞因子治疗、抗体治疗 和过继性细胞治疗四类。小动物活体光学成像技术可以在活体动物水平无创地监测:1、疫苗、抗体、 免疫细胞等在体内的分布及病灶靶向;2 、评价免疫疗法的治疗效果;3 、评价治疗手段对机体免疫系 统的影响。以下将围绕上述四类免疫疗法策略,详细介绍活体光学成像技术在肿瘤免疫治疗中的应用。
一.肿瘤疫苗相关研究
肿瘤疫苗是通过激活患者自身免疫系统,利用肿瘤细胞或肿瘤抗原物质诱导机体的特异性细胞免 疫和体液免疫反应,增强机体的抗癌能力,阻止肿瘤的生长、扩散和复发,以达到清除或控制肿瘤的
目的。肿瘤疫苗分为预防性疫苗和治疗性疫苗,前者将与某些特定肿瘤发生有关的基因制备成疫苗, 接种于具有遗传易感性的健康人群,预防肿瘤的发生,后者主要用于化疗后的辅助治疗。根据肿瘤疫 苗的来源,又可分为肿瘤细胞疫苗、基因疫苗、多肽疫苗、树突状细胞疫苗、细胞毒性 T 淋巴细胞(cytotoxic lymphocyte,CTL)表位肽疫苗等。应用 Revvityr IVIS 小动物活体成像技术可以无创地监测肿瘤疫苗 的预防及治疗效果、疫苗在动物体内的分布靶向及疫苗刺激机体产生的免疫效应等。
1. 以细菌为载体的预防性肿瘤疫苗
人表皮生长因子受体 2(HER2)的高表达、点突变及基因删除与多种癌症(乳腺癌,卵巢癌,胰 脏癌,胃癌和直肠癌)紧密联系。单核细胞增多性李斯特菌(Lm,Listeria monocytogenes)是一种兼 性胞内寄生菌,可以用于疫苗载体。给予 Balb /c 小鼠进行新型单核细胞增多性李斯特菌-人表皮生长因 子受体 2 嵌合疫苗免疫注射,然后静脉注射萤火虫荧光素标记的小鼠乳腺癌细胞(4T1-luc),利用 Revvityr 的 IVIS 成像系统即可实时监测肿瘤的生长,进而评价疫苗的预防效果。结果显示经嵌合疫 苗免疫的乳腺癌模型小鼠的生物发光强度明显弱于单核细胞增多性李斯特菌免疫的对照组(下图) 。 研究表明细菌受体嵌合疫苗能够明显推迟肺癌肿瘤的发生,转移,并能有效提高小鼠存活率
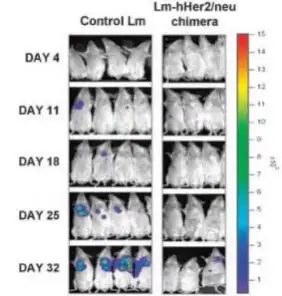
Balb/c 小 鼠 免 疫 单 核 细胞增 多性 李 斯特 菌 (control Lm),或者单核细胞增多性李斯特菌- 人表皮生长因子受体 2 嵌合疫苗(Lm-hHer2/neu chimera)。然后静脉注射萤火虫荧光素标记小鼠 乳腺癌细胞(4T1-luc)
Seavey et al.,Clin Cancer Res 2009;15(3):924-32.
.
2. 溶瘤病毒介导的治疗性肿瘤疫苗
CG0070是在卡介苗(BCG)对膀胱癌安全性和剂量评价失败后,Cell Genesys公司研制的肿瘤治疗 性疫苗,该疫苗在2005年进入I期临床试验,涉及35例非肌肉浸润性膀胱癌(NMIBC)的治疗。目前Cold Genesys已经引进该药物,并在2014年3月开始招募2/3期研究,并有望在2018年获得最终数据。CG0070 治疗肿瘤的作用是通过双重机制来完成的,首先该疫苗是一种条件复制型溶细胞腺病毒,可以直接靶 向肿瘤细胞并在肿瘤细胞中增殖,干扰肿瘤细胞生长;其次该病毒表达粒细胞-巨噬细胞集落刺激因子 (GM-CSF),使体内树突状细胞和T细胞加入战斗。Cell Genesys公司在研究中利用Revvityr的IVIS 系统,评价了在小鼠原位膀胱癌的移行细胞癌(TCC)模型中CG0070的抗肿瘤活性。结果显示PBS组 小鼠给药42天时较初次给药,肿瘤的生物发光信号强度大幅增加(1只小鼠无明显变化),在CG0070治 疗组(1周1次,连续6周)9只小鼠中有4只在42天时已经检测不到肿瘤信号。而另一CG0070治疗组(1 周2次,连续3周)中,8只动物中5只在32天时未检测到肿瘤信号,1只小鼠的肿瘤信号减少,其他肿瘤 大小稳定未增长,只有一只肿瘤信号增强。另外, 免疫组化结果显示CG0070治疗组中无肿瘤的小鼠在 膀胱组织未检测出肿瘤细胞。
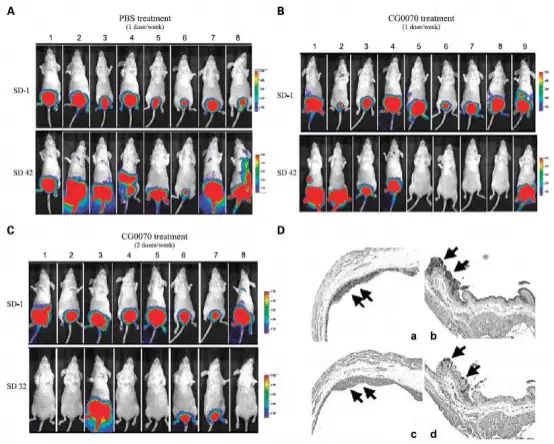
SW780-Luc 原位膀胱肿瘤模型评价CG0070效果。( A – C):建立模型后,小鼠膀胱灌注50 μl PBS或者CG0070 (3 ×1010病毒 颗粒/次) 共计6次,为了监测肿瘤的生长,每周使用IVIS系统进行生物发光成像;图像如上图所示。D :CG0070在瘤内复制 的肿瘤切片图(n=4),首次给药24小时后取小鼠膀胱(a,c:PBS;b,d:CG0070),对石蜡包埋的膀胱组织切片进行染色,肿瘤检 测使用人膀胱癌SW780细胞20AE1抗体(a和 b) ,病毒复制监测进行hexon蛋白染色(c 和d)。二者免疫组化都使用
3,3V-diaminobenzidine 染色,箭头所指为抗体相互作用的区域。 Ramesh et al., Clin Cancer Res.2006;12(1): 305-13.
3. 多肽类肿瘤疫苗
多肽疫苗是按照病原体抗原基因中已知或预测某段抗原表位的氨基酸序列,通过体外合成技术制 备而得到的多肽片段。Gp100 是胚胎早期出现的分化抗原,在黑色素瘤中过度表达,属于黑色素肿瘤 相关抗原。gp100 疫苗(福氏不完全佐剂 IFA 为乳化剂)III 期临床研究表明,使用疫苗免疫病人的客 观有效率高于高剂量 IL-2 治疗组一倍,同时也增加病人无疾病进展生存时间。然而在外周血增加的特 异性 CD8+T 细胞反应,并没有有效的引起肿瘤的缩小,这一现象同样是众多疫苗临床试验中遇到的问 题。Yared Hailemichael 认为,这主要是由疫苗佐剂 IFA 引起的,该佐剂以矿物油为基础,广泛应用于 疫苗开发,以增强免疫应答。为了验证这个论点,研究人员对 T 细胞进行了光学标记,并使用 Revvityr 的 IVIS 成像系统对 T 细胞进行长期追踪。结果显示,在接种了不含 IFA 疫苗的小鼠体内,发光 T 细胞 大量存在于肿瘤中,而接种位点处很少;接种了含 IFA 疫苗的小鼠体内,T 细胞在注射位点处聚集,
而肿瘤中很少。并且抗原/IFA 能够持续在接种位点聚集,在接种30 天后仍能在该处刺激 T 细胞增殖。 最终使机体产生一系列诱导细胞自杀的蛋白,使接种处的 T 细胞自杀。
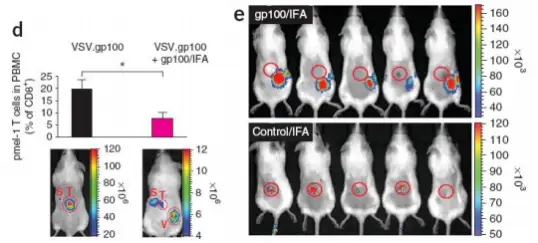
gp100/IFA免疫导致CD8+T细胞启动和低反应性。d.血液中pmel-1T细胞的平均数量(上), 白化C57ABL/6小鼠接种黑色素瘤7 天,肿瘤大小可触,经疫苗免疫gp100/IFA(s.c) 或/和VSV.GP100(表达gp100的水泡炎病毒,iv),在IL-2治疗3天后尾静脉注射 1×106V-effLuc-pmel-1 T细胞,免疫4天后进行生物发光成像,T:肿瘤、V:免疫位点、 S :脾脏;e.B16黑色素瘤模型小鼠, 在IL-2治疗3天后尾静脉注射1×106V-effLuc-pmel-1 T细胞,gp100/IFA或者control/IFAs.c.免疫7天后成像,圆圈显示肿瘤的位置; 结果显示VSV.GP100免疫小鼠后pmel-1 T细胞在血液中迅速扩增,并且在肿瘤中累积,而VSV.gp 100和gp100/IFA共免疫组,
在血液中也检测出pmel-1T细胞,但是主要集中在注射位点,肿瘤中累积很少。
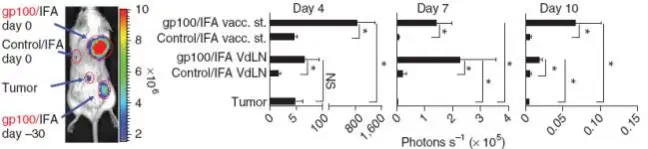
gp100/IFA免疫诱导长期的抗原递呈和T细胞隔离。(a)白化C57ABL/6小鼠接种黑色素瘤7天,IL-2治疗3天尾静脉注射
1×106V-effLuc-pmel-1 T细胞,在皮下接种疫苗gp100/IFA的0天,-30天或者control/IFA的0天时进行成像及定量分析。之前结果 显示,T细胞在注射位点的积累是抗原刺激产生的,此实验考查的是gp100/IFA引起这种效应可以持续多长的时间,结果显示, 相较其他位点,Pmel-1T细胞积累在0和30天前接种的gp100/IFA
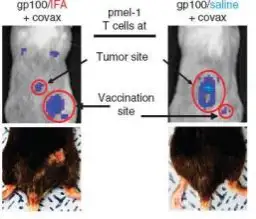
使用短期水佐剂疫苗 T 细胞则定位在肿瘤。(a)白化 C57ABL/6 小鼠接种黑色素瘤 7 天,IL-2 治疗 3 天尾静脉注射
1×106V-effLuc-pmel-1 T 细胞,在皮下接种疫苗 gp100/IFA 的 0 天,-30 天或者 control/IFA 的 0 天时进行成像和定量分析。
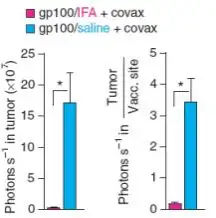
结果显示新型的盐/肽/covax 疫苗比 IFA/肽/covax 疫苗更有优势,前者能使 T 细胞集中攻击肿瘤细胞,而后者确使 T 细胞聚集 在集中的位点,杀死正常组织并诱导趋化因子的生成,最终导致 T 细胞的死亡。
Yared Hailemichael et al., Nature Medicine.2013; 9(4): 465-76.
4. 树突状细胞疫苗
树突状细胞(DC)是目前所知功能最强的专职抗原递呈细胞。DC疫苗是将体外培养的负载肿瘤抗 原的DC导入体内,这些DC通过抗原提呈功能及分泌细胞因子调节肿瘤抗原特异性、Th1细胞增殖活化, 并进一步促进NK细胞及CTL活化,介导肿瘤杀伤。例如在2010年4月29日第一个被FDA批准的治疗性 疫苗Dendreon的Provenge正是DC疫苗。Laura Alaniz利用Revvityr IVIS小动物活体成像技术监测了在 小鼠结肠癌模型中,通过低分子量透明质酸(LMW HA)预处理的负载肿瘤抗原的DC疫苗,更倾向于 向淋巴结的迁移,从而增强诱导的抗肿瘤免疫反应。
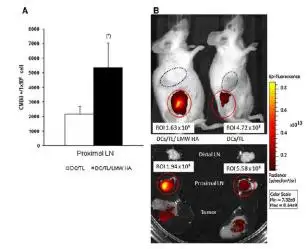
BALB/c小鼠皮下接种5×105 个CT26细胞,建 立小鼠皮下瘤模型。在接种7天后,用脂溶性 荧光染料Dir标记DC/TL/LMW HA或DC/TL 细胞,并将1×106 标记的细胞,皮下注射到 肿瘤结节和局部淋巴结之间。48h后进行活体 或离体组织成像。
Laura Alanizetal., Cancer ImmunolImmunother.2011; 60(10):1383-95.
二.细胞因子疗法
高纯化或重组细胞因子生产的实现,为细胞因子在临床的应用提供基础。细胞因子疗法是基于某 些细胞因子注射到体内后可调节、增强一种或多种免疫细胞的功能,发挥更强的抗肿瘤免疫功能。目 前临床上常用的细胞因子有白细胞介素 12(Interleukin-12,IL-12)、肿瘤坏死因-α(Tumor Necrosis Factor-α,TNF-α)、干扰素γ(Interferon-γ,IFN-γ) 及集落刺激因子(Colony Stimulating Factor ,CSF)等, 现细胞因子疗法多与其他方式结合来进行肿瘤的治疗。
白细胞介素13(Interleukin-13,IL-13)是一种T细胞衍生的II型细胞因子,在调节肿瘤进程、新血管 形成、免疫监视和肿瘤转移方面扮演着重要的作用。IL-13可以结合IL-13Rα1和IL-13Rα2两个受体亚型, 刺激下游信号通路级联放大,调节细胞的增殖和细胞抑制效应或肿瘤细胞死亡。其中IL-13Rα2已经被 认为是多种恶性肿瘤细胞系和病人肿瘤组织的标志物,例如人类恶性胶质瘤、头颈癌、卵巢癌和肾细 胞癌等。因此靶向IL-13Rα2是一种合理的有前景的肿瘤治疗手段。IL13-PE38由细胞因子IL-13和假单胞 菌外毒素(PE)的突变体组成,该复合物不仅对IL-13R2阳性的肿瘤具有高毒性,在IL-13R2阴性的肿 瘤转染表达IL-13R2后,IL13-PE38同样具有很高的敏感性。利用Revvityr的IVIS系统即可对
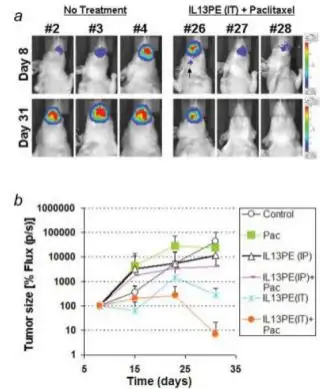
IL13-PE38对肿瘤的治疗效果进行评价;结果显示IL13-PE38和紫杉醇联合对小鼠OSC-19舌肿瘤模型具 有很好的治疗效果。
联合用药的药效学评价。OSC-19 (2×105 cells/30μl)接种到6周龄裸鼠舌头的边缘, 建立原位的口腔鳞状癌模型,肿瘤接种5 天后可见明显肿瘤。小鼠随机分为两组 (6-7只/组),在第8天开始注射
IL13-PE38(100 μg/kg),连续注射5天,随后交 替3天注射紫杉醇(10 mg/kg/day),并且分别在 第8天和第31天对肿瘤进行成像。箭头所指的 是淋巴结的转移 (b) 生物发光信号进行定量 分析代表肿瘤的生长曲线。
Mitomu KioiInt etal.,Int J Cancer. 2009;124(6):1440–8.
IFN-λ 是由T 细胞产生,具有抑制肿瘤细胞增殖、增加表面 MHC 抗原和肿瘤坏死因子的表达、抗 肿瘤血管生成等功能,在肿瘤临床治疗中应用多年。使用 IFN-λ 质粒能够调节体液和细胞免疫反应,
从而达到抗肿瘤或感染性疾病的目的。通过尾静脉注射大体积的质粒 DNA(水动力学注射方法)可引 起基因在啮齿类动物肝脏的表达,因此该注射方法在靶向肝脏转移位点进行基因递送方面具有广阔前 景。Atsuko Sato 在研究中利用Revvityr IVIS 成像系统评价了水动力学注射的 IFN-λDNA 质粒在小 鼠结肠癌肝转移模型中的抗肿瘤效果。
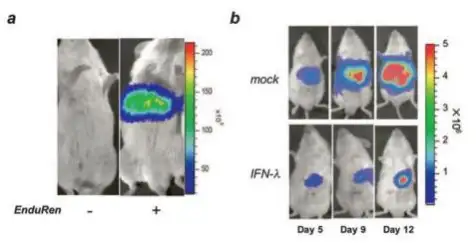
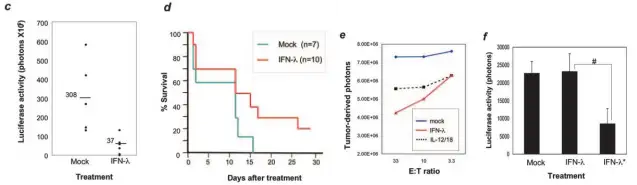
通过水动力学注射IFN-λ cDNA治疗肝转移。Luc-Colon26细胞通过门静脉接种在BALB/c的肝脏。a.海参荧光素酶表达载体作 为共注射的对照Marker来验证水动力学的可行性,在注射海参荧光素酶的底物后BALB/c小鼠肝脏产生了大量光子;b.在腹腔
注射萤火虫荧光素酶的底物后可监测肿瘤的生长;c.通过测量肝脏的光子数来评价luc-Colon26肝脏的转移;d.IFN-λ延长了肝 转移小鼠的生存率;e.luc-B16/F10细胞毒性分析实验,C57BL/6J 小鼠通过皮下注射辐射灭活的cDNA-转染的luc-B16/F10细胞 进行免疫,随后分离免疫小鼠的脾脏细胞,在E:T比例中作为效应细胞。光子数代表不同处理后细胞的存活;f.评价肺癌转移 模型中各方法的治疗效果。
Atsuko Satoetal.,J Immunol.2006;176(12):7686-94.
三.抗体疗法
肿瘤免疫药物的开发就技术成熟度和成功性来说,抗体技术是硕果累累。抗体进行肿瘤的免疫治 疗靶点主要是免疫检验点,或者结合正向共刺激因子的激动剂,例如西妥昔单抗(爱必妥)、帕尼单 抗(Vectibix)和曲妥珠单抗(赫赛汀)等。或者结合负向共刺激因子的抑制剂,如热点靶点 CTLA-4、 PD-1 、PD-L1 等。 目前 CTLA-4 单抗(lpilimumab)和 PD-1 单抗(nivolumab)已经先后被 FDA 批准分 别用于治疗晚期黑色素瘤和特定的转移性鳞性非小细胞肺癌。现在针对免疫检验点的单抗开发竞争十分 激烈,如 lambrolizumab(PD-1)和 MPDL3280A(PD-L1)已经进入后期临床,其他针对 OX40 、4-1BB 的 多个单抗在早期开发中。因为 T 细胞激活的靶点众多,因此有望开发出新的抗体药物,扩大肿瘤治疗 的范围。利用 Revvityr 的 IVIS 小动物成像技术可无创地对抗体的治疗效果进行评价,同时也可对 药物的靶向分布进行研究。
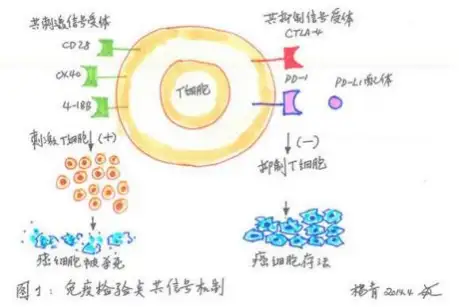
免疫检验点共信号机制
1. 药效评价
利用荧光素酶标记肿瘤细胞,并移植入动物体内建立肿瘤疾病动物模型,应用小动物活体光学成 像技术观测给药后肿瘤光学信号的变化情况,进而评价不同药物、特定的给药途径、时间、剂量等给 药策略对于肿瘤的治疗效果,如下图:
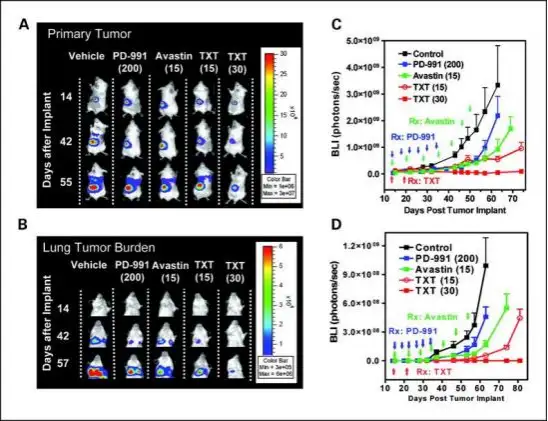
药效评价研究:利用萤火虫荧光素酶标记 MDA-MB-435 乳腺癌细胞株,将细胞注入小鼠肾包膜下构建肾包膜肿瘤模型,进而 对 3 种不同药物或不同剂量的治疗效果进行评价。(A,C)应用 IVIS 成像系统长期观测 3 种药物对肾包膜乳腺癌移植瘤的治 疗效果,并进行定量分析,结果显示 30 mg/kg Docetaxel(TXT)对肿瘤的生长抑制效果最好;(B,D)应用 IVIS 成像系统长 期观测 3 种药物对肾包膜乳腺癌移植瘤肺部转移的抑制效果,并进行定量分析,结果显示 30 mg/kg Docetaxel(TXT)对肿瘤 转移的抑制效果最好。
Zhang et al.,Clin Cancer Res.2009;15(1):238-46.
2. 观测药物靶向、分布及代谢
除了在药效学中的应用,小动物活体光学成像也广泛应用于药物在体内靶向、分布及代谢的研究。 与药效学中的应用不同,此类应用是以药物为直接观测对象,因此标记方式通常是利用荧光探针直接 标记药物本身,通过追踪荧光信号而反映药物在体内的分布情况。
例如在研究抗体或多肽类药物是否能够有效靶向肿瘤的实验中,可以利用荧光染料通过化学键的 结合标记目标抗体或多肽,经尾静脉注射后,利用小动物活体光学成像系统观测上述标记对象的肿瘤 靶向性,如下图:
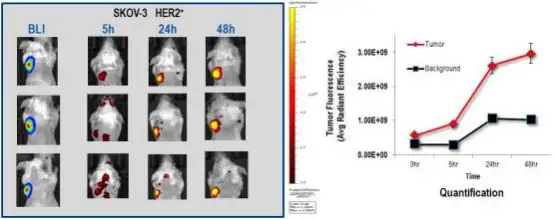
药物的肿瘤靶向性研究:利用 VivoTag 645 荧光染料标记抗癌药物曲妥珠单抗(Trastuzumab),尾静脉注入携带 HER2 阳性人 卵巢癌 SKOV3 的 SCID 小鼠体内,通过荧光成像观测不同时间点药物对肿瘤的靶向情况(左上图后三列),肿瘤本身已被荧 光素酶标记而通过生物发光成像(左上图最左列),右上图为荧光定量分析结果,标明曲妥珠单抗对 HER2 阳性的人卵巢癌 SKOV3 具有良好靶向性。
在研究药物靶向的同时,了解不同时间点药物在动物体各个器官的分布及最终代谢情况同样必不 可少。Revvityr 的 FMT 小动物活体荧光断层成像系统可以很好的满足此类应用需求。应用FMT 成 像系统,能够对荧光标记的药物在深层器官的分布进行断层扫描及三维重建,获得真实准确的三维定 量数据,进而对药物的体内分布代谢情况作出正确分析。如下图:
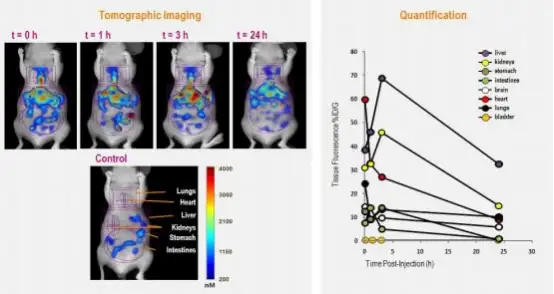
上图左:利用 FMT 成像系统观测不同时间点经荧光染料 VivioTag 680 标记的 BSA 在小鼠不同器官的分布;上图右:不同时 间点不同器官 BSA 分布的定量结果。
四.过继性免疫细胞疗法
过继性免疫细胞治疗(adoptive cell transfer therapy ,ACT),是指从肿瘤患者体内分离免疫活性细 胞,在体外进行扩增和功能鉴定,然后向患者回输,从而达到直接杀伤肿瘤或激发机体的免疫应答杀 伤肿瘤细胞的目的。ACT 分为非特异性免疫治疗(如CIK 细胞治疗、LAK 疗法)及特异性免疫治疗(如
嵌合抗原受体 T 细胞免疫疗法,CAR-T)。尤其是 CAR-T 细胞疗法已经成为细胞疗法中的热点,其中 Novartis 团队主导的二期临床实验取得了迄今肿瘤免疫界最好的结果,在三十个病人中,二十七患者已 经没有临床肿瘤的症状和肿瘤的指征。而在国内北大国际医院等机构也都在进行CAR-T 细胞治疗研究, 并已经进入临床试验阶段。
人类NK细胞,在抗肿瘤中起着重要的作用,代表表达CD3-/CD56+ 的大颗粒淋巴细胞群。NK细胞 通过NK细胞受体和靶细胞配体之间的相互作用来区分正常细胞和转化的细胞。转染TNF配体超家族成 员的41BBL和IL15的K562细胞(K562-mb15-41BBL)经辐射灭活后能够刺激NK细胞高度活化并大量的 扩增。经K562-mb15-41BBL活化的NK细胞高表达IFN-γ、TNF等。Tarun K等研究了这种NK细胞体系对 多发性骨髓瘤的治疗作用。研究中将稳定表达萤火虫荧光素的白血病细胞系OPM2接种在
NOD/scid/IL2Rγnull小鼠皮下后,利用Revvityr IVIS小动物活体成像技术可实时检测肿瘤的生长,从 而对exp-NK细胞的疗效进行评价。
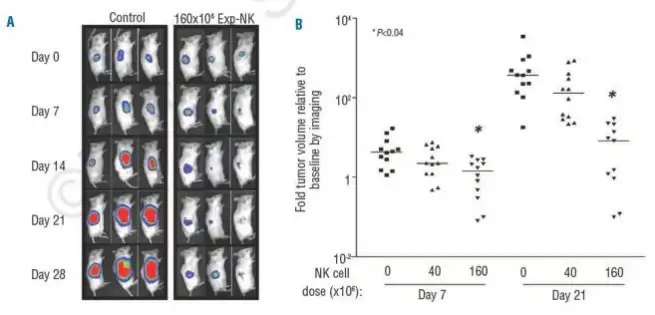
NOD/scid/IL2Rγnull-hu模型中,exp-NK细胞显著抑制转染荧光素酶基因的OPM2骨髓瘤的生长。(A)3×105OPM2-luc细胞皮下 接种,7天后可见明显肿瘤。随后分别给予PBS和总剂量160×106 exp-NK细胞(分4次注射,间隔48h)进行处理,并在不同时 间点对肿瘤进行生物发光成像(Day0代表NK细胞注射的时间)。#1.一周两次静脉注射 IL2 (100 U),延长模型小鼠存活时间;
(B)各组相对体积进行比较,结果显示与对照和低剂量组相比160×106 exp-NK细胞治疗组肿瘤体积最小。 Tarun K..et al.haematologica.2012;97(9):1348-57.
继发性T细胞对于治疗多种癌症具有很好的前景,但是临床应用时遇到一个问题,即如何将靶向淋 巴细胞递送到肿瘤位点并在免疫抑制的微环境中扩增。Stephan在研究中设计了一个具有生物活性的多 聚物,通过将移植物置于无法手术的肿瘤附近或部分切除肿瘤的切除位点,能够递送、扩增和分散肿 瘤激活的T细胞。利用萤火虫荧光素酶标记肿瘤细胞,甲壳虫荧光素酶标记肿瘤特异性T细胞,使用
Revvityr IVIS成像系统即可监测肿瘤的生长及T细胞的分布。成像结果显示在小鼠乳腺癌切除模型 中移植物能够有效的支持肿瘤靶向的T细胞通过切除位点与淋巴结交集,减少肿瘤的复发。在多病灶的 卵巢癌转移模型中多聚物递送的T细胞能够导致肿瘤的退化,而只用肿瘤活化的T细胞进行治疗时效果 甚微。
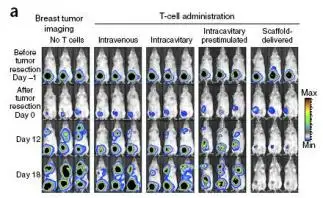
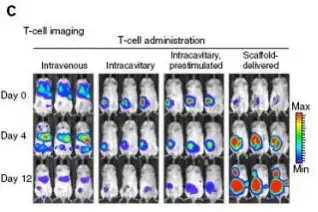
不同处理方式下肿瘤和T细胞的成像,建立小鼠4T1-luc乳腺癌脂肪垫模型,乳腺癌特异性T细胞分离自经辐射灭活的4×106 4T1 B7.1/4-1BBL免疫的BALB/c小鼠(辅助CpG基序的寡脱氧核苷酸和Poly(I:C)),获取的特异性T细胞经慢病毒转染的方式 获得CBR-LUC基因,成像前分别注射F-luc和CBR-luc的底物进行肿瘤或T细胞的生物发光成像。
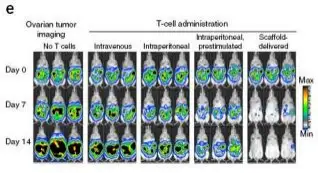
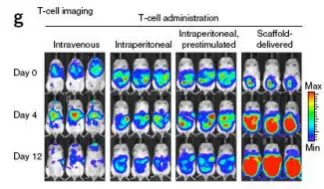
不同处理方式下肿瘤和T细胞的成像, 建立小鼠ID8-VEGF-luc卵巢癌腹腔转移模型,为了获得卵巢癌特异性(NKG2D CAR-transduced)T细胞,取C57BL/6J小鼠的脾脏,过滤后重悬于裂解液中,分离的脾细胞使用含1 ng/ml interleukin-7和2μg/ml Concavalin A的完全培养基RPMI1640培养,并纯化获得CD8+效应T细胞, CD8+效应T细胞先后转染NKG2D-CAR基因和 CBR-luc。成像前分别注射F-luc底物和CBR-luc的底物进行肿瘤或T细胞的生物发光成像。
Sirkka B Stephan etal.,nature biotechnology.2015;33(1):97-104.
多形性成胶质细胞瘤是最具有侵略性的原发性脑瘤。目前来说,手术切除结合放射和化学疗法是 治疗多形性成胶质细胞瘤最好的方法。然而对于中老年患者,放射和化学治疗只能减缓而不能阻止肿 瘤细胞生长。CD133+肿瘤干细胞的化学和放射疗法耐药性能够解释传统疗法低效率的原因。正位异种 移植萤火虫荧光素酶标记的患者来源的多形性成胶质细胞瘤细胞到免疫缺陷小鼠(SCID)前额叶,建 立多形性成胶质细胞瘤小鼠模型。肿瘤内注射 HER2 靶向的嵌合性 T 细胞,Revvityr 的 IVIS 系统 成像显示经过特异性 HER2+T 细胞治疗小鼠的生物发光明显下降(下图)。结果说明特异性 HER2+T 细 胞能够抑制多形性成胶质细胞瘤的生长,从而对多形性成胶质细胞瘤患者进行有效治疗。
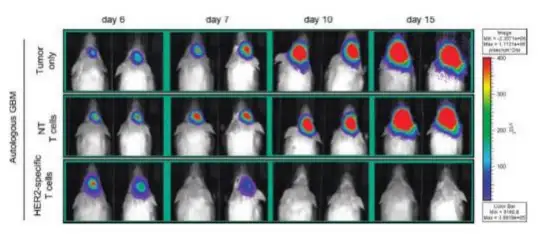
上图:首行(没有治疗的多形性成胶质细胞瘤小鼠)中行(T 细胞治疗多形性成胶质细胞瘤小鼠)末行(特异性 HER2+ T 细 胞治疗多形性成胶质细胞瘤小鼠)。
Ahmed et al, Clinical Cancer Research, 2010;16(2):474-86.






















