随着科研水平的日益发展,对于疾病及相关治疗的研究已越来越多的由体外分子及 细胞水平转移到活体动物水平层面,而传统的仪器和方法很大程度限制了研究人员在活 体动物水平直接监测疾病的整体发展过程以及新药的临床前研发。因此,构建基于活体 动物水平的新型研究平台是开展疾病研究及药物研发的重要基础。小动物活体光学成像 系统是将分子及细胞生物学技术从体外研究水平发展到活体动物研究水平的前沿性临 床前分子影像技术,该技术通过采用生物发光与荧光探针标记研究对象,借助灵敏的光 学检测仪器,直接在活体动物水平监测疾病的发展变化并开展相关药物的临床前研发。 由于光学成像因为操作简单、灵敏度高、不涉及到放射性等优势, 已被越来越广泛地 应用于临床前疾病研究的各个领域,包括癌症研究、器官损伤研究、心血管疾病研究、 神经疾病研究、炎症疾病研究、免疫学及干细胞研究等。在新药的临床前研发阶段,全 球知名药企都已将小动物活体光学成像技术应用于药效和安全性评价研究、药物的靶向 及生物分布研究、新型药物载体的研发等新药临床前研究的多个方面。光学成像因为操 作简单、灵敏度高、不涉及到放射性等优势,应用非常广泛,包括生命科学、药学和材 料学等众多领域。同样小动物活体光学成像技术在肝损伤领域也发挥着重要的作用。四 氯化碳(carbontetrachloride,CCl4)是一种强烈的能够引起肝细胞坏死的化合物,一直被研 究者用来诱发各种肝损伤模型以阐明化合物肝毒性机制或肝损伤保护机制。CCl4会引 起氧化应激反应,从而引起自由基变化、引发与环氧化酶(COX)介导的炎症反应相关 反应,CCl4自身的溶酶作用可导致肝细胞损伤等,通过小动物活体光学成像技术即可 在活体状态下检测肝脏损伤时细胞和分子水平的这些生物过程,并可对治疗肝损伤的药 物和干细胞等的治疗效果和分布、靶向等进行评价。以下是详细的阐述。
一.利用荧光指示探针检测肝脏的氧化损伤
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基 (reactive oxygenspecies,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过 多,氧化程度超过氧化物的清除,氧化系统和抗氧化系统失衡,从而导致组织损伤。大 量的研究显示,氧化应激参与了多种肝脏疾病的形成发展过程,例如酒精性和非酒精性 脂肪肝、病毒性肝炎、肝纤维化、肝癌、缺血再灌注的损伤。斯坦福大学Shuhendler教 授在2014年发表一篇文章,在文章中就设计并研发了一种肝脏氧化损伤的指示剂。其原 理正是基于肝损伤的两个关键生物标志物——ROS和RNS,二者的产生机制不同,因此 对两者同时检测可广泛的检测疾病、化合物、药物等对肝脏造成的氧化损伤及对不同治 疗方法的效果做出评价。此指示剂是一种半导体聚合物纳米粒(semiconducting polymer nanoparticle,SPN),包含三个核心元件:(1)靶向元件:通过聚乙二醇联连接半乳糖 残基,可以与肝细胞表面的半乳糖受体结合,是一种常见的肝靶向方法;(2)活性氧 感应元件:化学发光剂双草酸酯(CPPO)在活性氧存在的条件下,迅速分解产生高能 中间体1,2-二氧杂环丁烷二酮,激发附近染料分子发光,检测发出的光子强度即可评活性氧的程度;(3)活性氮感应元件:青色素染料IR775S发射680nm、820nm两种荧光, 因荧光能量偏振转移(FRET),发射的680nm的光子作为激发光激发染料分子发射出 820nm的光,而680nm光子减弱甚至消失;而在活性氮存在的条件下,FRET现象消失 680nm荧光信号增强,检测此信号的强度即可评价活性氮的强度。
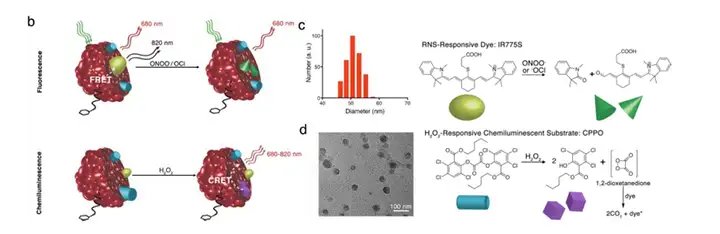
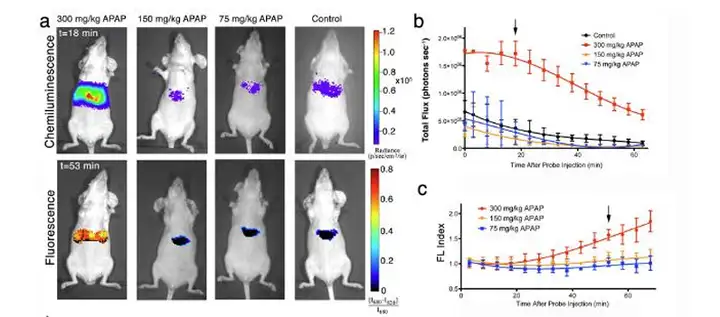
上图,不同剂量药物对小鼠肝脏造成的氧化损伤毒性。Nat Biotechnol. 2014 April ; 32(4): 373–380.
二.利用水动力学模型检测肝脏损伤
水流动力学注射(hydrodynamic-based procedure)是一种高效的基因转移方式,即 将约小鼠体重8-10%的质粒DNA溶液在短时间内快速注射到小鼠体内,这种方法能让 表达载体稳定存留在肝脏一段时间并进行表达。水动力注射是非常成熟的方法,军事医 学科学院詹林盛研究员就利用水动力学模型开展了一系列围绕肝脏疾病的研究,例如丙 型肝炎、肝脏毒物代谢等,已经成功建立了多种小鼠肝脏荧光素酶调控模型。例如詹林 盛研究员在2013年建立了在活体水平检测肝脏NF-κB表达的模型小鼠。NF-κB信号通 路在维持机体正常的生理功能中起到很重要的作用。经典的NF-κB信号通路与基体的 自身免疫有关,而炎症反应是自身免疫反应的重要表现形式,因此NF-κB的表达可以 代表炎症的发生和发展。同样在CCl4诱导产生急性肝损伤中,NF-κB信号通路会被激 活。在实验中将pattB-NF-κB-Fluc 报告载体和φC31o整合酶载体通过水动力学方式注射 到小鼠体内,在整合酶的作用下pattB-NF-κB-Fluc会重组到肝细胞的染色体中,这样就 可以实时监测NF-κB在肝脏的激活表达情况,从而达到判断肝脏的损伤程度及药物治 疗效果的目的。
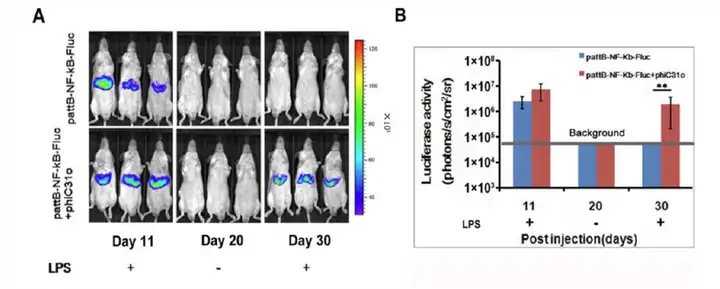
上图,pattB-NF-κB-Fluc 载体单独或与φC31o 整合酶载体共同注射组,在注射后第11天和30天分别给予LPS注射后,进行生物发光成像和定量分析。从结果可以看出pattB-NF-κB-Fluc载体与φC31o整合酶载体共同注射组,NF-κB已经整合到肝脏细胞的基因组中,可长期检测肝脏的损伤。
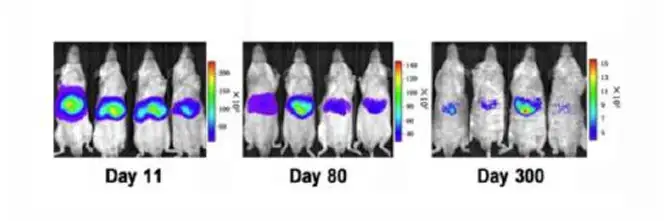
上图.双载体水动力注射模型小鼠中分别在第11、80、300天的时候进行生物发光成像检测NF-κB的表达,从结果看出300天后仍能检测到信号。
上图.利用该模型进行药物评价的可能性。Shaoduo Yan,et al.,Theranostics 2013, 3:841-849
细胞凋亡是CCl4造成肝损伤的另一个机制,而caspase-3被认为是最终的凋亡执行分 子,詹林盛研究员同样用水动力学注射方法建立了实时监测肝脏细胞凋亡的模型小鼠, 该模型是attB-ANLuc(DEVD)BCLuc和φC31o整合酶载体采用水动力学方式注射到小鼠 体内,同样在整合酶的作用下,attB-ANLuc(DEVD)BCLuc会重组到肝脏细胞的染色体 中稳定表达。ANLuc(DEVD)BCLuc是将荧光素酶基因的N端和C端分别连上能够相互作 用的蛋白A、B的基因,两者之间以caspase-3识别位点相连,当肝脏未发生凋亡时caspase-3 不表达,荧光素酶的N端和C端由于空间位置受阻无法形成完整的荧光素酶结构,不能 催化底物反应产生发光信号,而一旦凋亡发生caspase-3随即表达就会将荧光素酶的N端 和C端之间的肽段去除,在A、B蛋白的相互作用下,就会形成完整的荧光素酶结构,能 够与底物反应产生发光信号。利用该小鼠模型即可实时检测caspase-3的表达,从而评价 肝脏细胞的凋亡。
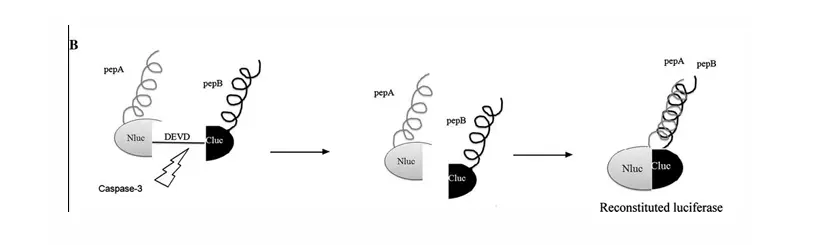
原理示意图
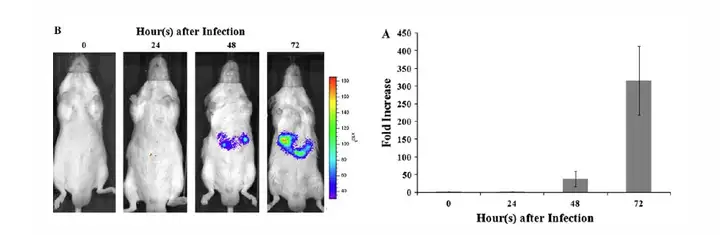
上图,水动力注射14天后,腹腔注射鼠肝炎病毒(MHV)后0-72小时进行生物发光成像检测肝脏细胞的凋亡情况。 Qiuxia Fu,et al.Apoptosis (2013) 18:998–1007
三.利用转基因小鼠检测肝损伤
CRISPR/Cas9等转基因技术的出现,使得建立转基因小鼠的成本大大降低,同时也 缩短了转基因小鼠构建的周期,因此更利于利用转基因小鼠或大鼠的模型来对疾病发生 机制及治疗效果等进行研究。将荧光素酶的报告基因插入与肝脏损伤相关的基因的启动 子下建立转基因小鼠,即可在活体状态下,利用光学成像的方式对肝脏损伤进行实时动 态的检测。
血红素氧化酶(Heme oxygenase,HO)是一种催化血红素的起始酶和限速酶,有 着重要的生物作用。HO在体内主要有三种同工酶形式,即HO-1、HO-2和HO-3。这 三中酶是不同基因的表达产物,但均能作用于血红素将其分解产生相同摩尔数的生物活 性分子:一氧化碳、胆红素和铁离子。其中HO-1又称为热休克蛋白32是生物体内最 容易被诱导产生的抗氧化酶,HO-1在多数组织中不表达或低表达,但低氧、激素、氧 化剂等因素均能诱导其表达,能够调节细胞生理功能而发挥抗感染、抗氧化、抗细胞增 殖等作用,在众多疾病中发挥重要的生物学功能。研究发现,当小鼠或大鼠经腹腔注射 CCl4 建立急性肝损伤模型后,在注射CCL4 3小时后HO-1开始表达,12h时到达峰值, 而正常肝脏组织中未见HO-1表达,因此HO-1的表达水平可以作为肝损伤的一个指标, 从而来鉴定肝脏损伤程度及药物的治疗效果。将荧光素酶的基因插入小鼠HO-1基因启 动子下游建立HO-1-Luc转基因小鼠,即可应用生物发光的成像模式实时检测HO-1基 因的表达。
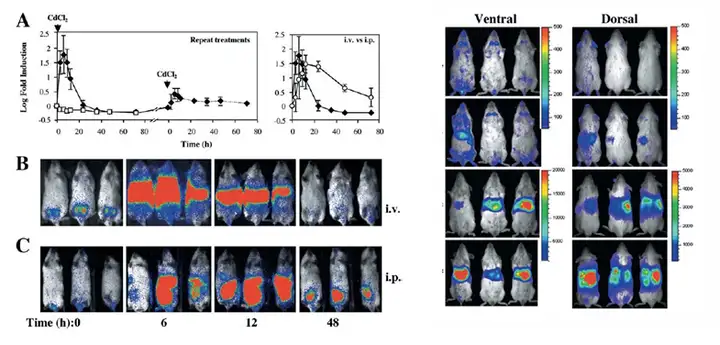
上图左.HO-1-luc模型小鼠在尾静脉或者腹腔注射CdCl2(10 μM)后HO-1表达随时间的变化, A左.尾静脉 注射CdCl2或PBS后进行长时间检测,并且当CdCl2组HO-1表达接近对照组时,重新注射CdCl2,A右.尾静脉 与腹腔注射CdCl2进行比较;B、C分别为尾静脉或腹腔注射CdCl2后进行生物发光成像的图像。右.不同剂量 CdCl2在尾静脉注射9小时后,模型小鼠正面和背面的生物发光图像,从上到下剂量分别为(control,5, 10, and 20 μmol/kg).Weisheng Zhang.et al.J Mol Med (2002) 80:655–664
血清淀粉样蛋白A(Serum amyloid A,SAA)是一种急性期反应蛋白,血中浓度主要由 合成速度决定,而肝功能正常时其合成主要决定于细胞因子的水平。当组织发生感染、 炎症或者损伤时,SAA可以诱导产生组织损伤修复过程所需的酶,吸引免疫细胞到达炎 症部位加强免疫反应作用。若外源的药物或化合物会引发机体产生损伤或炎症时,SAA 的表达会迅速上升,因此SAA也可以作为肝脏损伤的一个标志物。同样我们建SAA-Luc 转基因小鼠同样实时检测SAA的表达,从而肝脏的损伤程度。
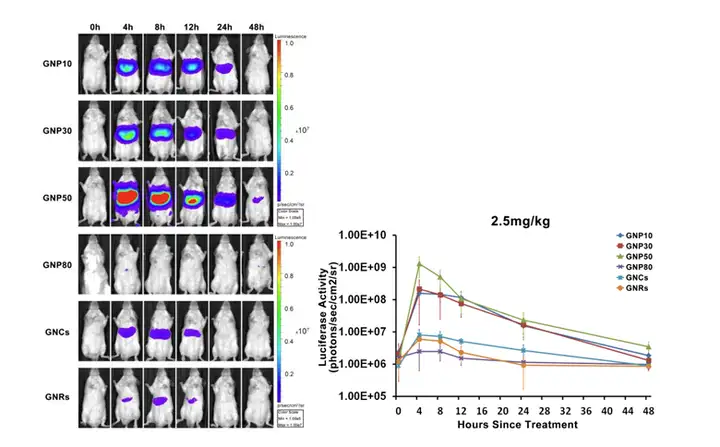
左图. Balb/c 小鼠,尾静脉注射GNP10/GNP30/GNP50/GNP80/GNRs/GNCs 等6种纳米金材料,注射浓度2.5mg/kg 小鼠体重 。分别在注射材料前,注射后4h/8h/12h/24h/48h进行活体荧光成像监测。
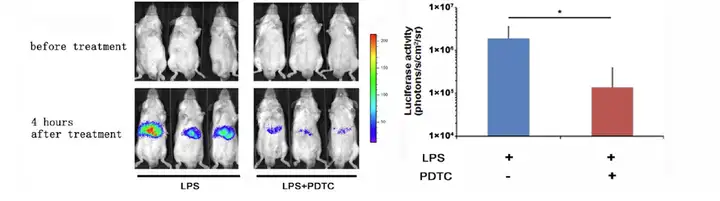
上述例子中提到CCl4诱导产生急性肝损伤中,NF-κB信号通路会被激活,因此我 们可以构建NF-κB-Luc转基因小鼠,通过生物发光成像模式即可实时检测 NF-κB的表 达,同样也可以达到判断肝脏的损伤程度及药物治疗效果的目的。例如下图就利用 NF-κB-Luc 转基因小鼠模型评价了牛樟芝对肝脏损伤的预防作用。从下图可以看出,LPS 注射后,腹腔出现很强的生物发光信号,其信号主要来源于肝脏,而经牛樟芝预防组则 信号明显弱于LPS诱导组,从而说明牛樟芝对LPS引起的肝脏的炎症损伤有一定的预 防效果。
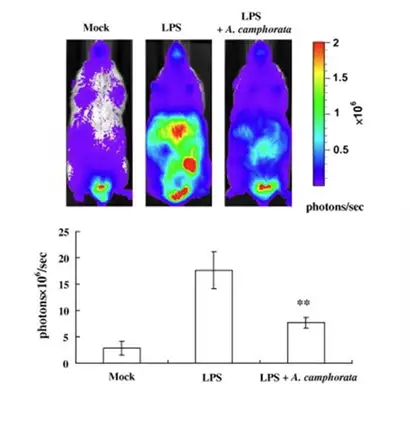
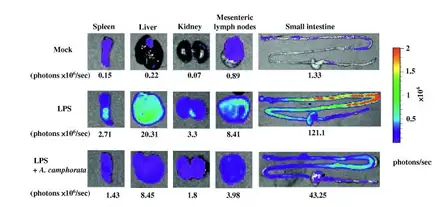
(A)应用LPS(脂多糖),LPS+A. camphorate(脂多 糖和牛樟菇),Mock(阴性对照)经腹腔注射后,小 鼠生物发光和定量结果。(B) 体外Spleen(胰脏)Liver (肝脏)Kidney(肾脏),Mesenteric lymph nodes (肠 系膜淋巴结),Small intestine (小肠) 的生物发光成像。 Hseu et al, Food and Chemical Toxicity,
四.利用光学探针检测肝脏的炎症反应
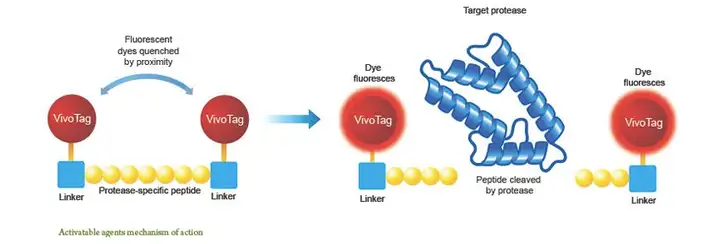
CCl4 腹腔注射后炎症相关的金属蛋白酶(MMP)-2和-9的表达增高,因此应用特 异性MMP敏感的荧光探针同样可以监测肝脏炎症发生发展及评价药物的治疗或预防效 果。该探针的原理是两个荧光基团通过MMP的底物肽段连接,此时由于二者接近,荧 光基团相互抑制,不能产生荧光信号,而当探针进入MMP高表达的炎症位点时,MMP 就会水解荧光基团之间的肽段,两个荧光基团分开产生荧光。而目前市场已有商品化的 荧光探针对MMP表达进行检测,此时荧光信号的强度可以反应炎症严重程度。
五.检测治疗性药物或干细胞在肝脏的分布
愈来愈多的证据表明,在适当的刺激下,MSCs在体外可以分化为正常的肝细胞, 因此间充质干细胞(mesenchymal stem cells,MSCs)移植在治疗肝损伤中有着很好的前 景。利用小动物活体光学成像系统,对MSCs在急性肝损伤小鼠体内进行动态示踪,了 解MSCs在小鼠体内迁移、分布和定植情况,从而在临床前动物水平评价MSCs移植治疗 肝损伤的可行性,并对注射剂量、注射次数、注射方式等变量进行研究。例如中山大学 第三附属医院的研究人员就将荧光素酶标记的MSCs通过不同的方式移植入肝损伤受体 小鼠的体内,通过生物发光成像的方式检测了MSCs在模型小鼠内的分布情况,结果发 现不同的移植方式MSCs的分布不同,经下腔静脉注射主要分布在小鼠肺部、经肠系膜 上静脉和心内注射的方式主要分布在肝脏。
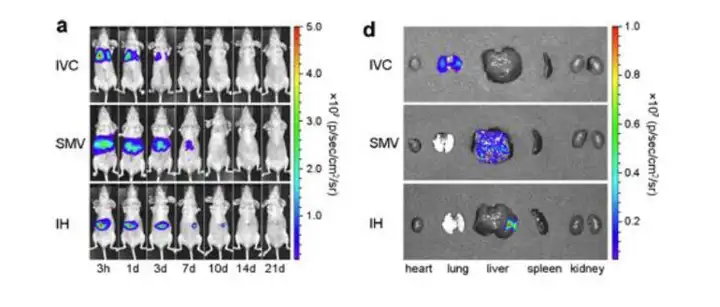
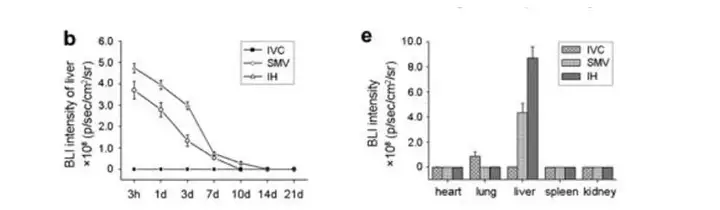
上图.急性肝损伤模型小鼠分别通过下腔静脉、肠系膜静脉和心内注射的方式接种2.5×105 MSCs-R 细胞后不同时间点进行生物发光成像和对肝脏信号进行定量,并在移植3天后进行脏器的解剖成像及定量。 Zhengran Li, et al.,Mol Imaging Biol (2015) 17:185-194.
同样采用荧光染料对治疗肝损伤的药物或药剂进行标记后,即可通过荧光成像的方 式实时监测药物对肝脏的靶向性及在动物体内的分布代谢情况。例如,Sun-Jung Kim 就设计了一种靶向肝脏的siRNA载体复合物,该复合物由以聚乙酰亚胺(PEI)为骨架, N-氨基葡糖胺(GlcNAc)为靶头(特异性靶向肝纤维化位点),ICG作为荧光指示剂,该 载体可携带siRNA用于肝纤维化的成像和治疗,在文章中Sun-Jung Kim利用小动物活体 光学成像技术评价了该载体对肝脏的靶向效果和实时分布。
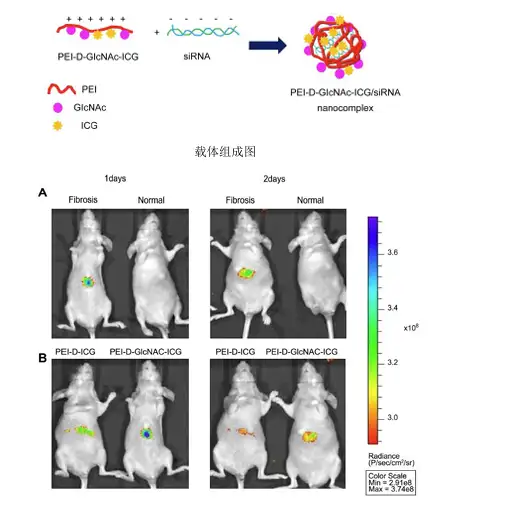
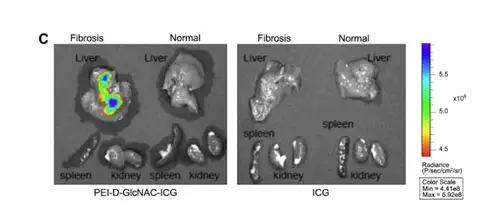
上图.A.肝纤维化和正常小鼠分别经尾静脉注射ICG标记的PEI-D-GlcNAc载体后1天、2天时进行活体成像;B.肝纤维化小鼠尾静脉分别注射PEI-D-ICG 或PEI-D-GlcNAc-ICG,1天两天时分别进行活体成像;C.A组小鼠离体组织成像。Sun-Jung Kim,et al.,Biomaterials 34 (2013) 6504-6514.
综上所述,小动物活体光学成像技术可以在活体状态下,在细胞和分子水平实时动 态的监测肝损伤发生、发展的整个过程,并对药物或干细胞等的治疗效果、分布、靶向 等做出准确的评价,是肝损伤研究领域的重要工具。


















