Wei Chi instrument
Your laboratory is always a good helper
热原-从皮下注射用针头说起
注射针头的发明提供了一种新的给药方式,但是早期的药物注射由于种种原因并不安全,经常伴随感染、不良反应、不明原因发烧甚至休克死亡。在19世纪下半叶,人们发现药物注射是导致体温异常升高的原因之一,但是具体机理并不清楚,因此这种“致热因子”导致的疾病被描述为“注射热”。
如今,大家对致热原的来源、分子机理越来越清晰,控制和检测越来越常规化,注射药物也越来越安全。引起恒温动物体温异常升高的致热物质,称为“热原”,从来源看包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等,从成分上看有细菌内毒素、脂质胆酸、CpGDNA、鞭毛蛋白和其他非内毒素热原(NEPs)。
热原与内毒素
致热能力强的“热原”是革兰氏阴性杆菌的产物,其次是革兰阳性杆菌类,革兰阳性球菌则较弱,霉菌、酵母菌、甚至病毒也能产生热原。大肠杆菌、铜绿假单胞菌等死亡或自溶后,游离脂多糖(LPS)可以从细胞表面或从制药用水系统生成的生物膜释放出来,或者从原料进入制药用水或无菌系统。由于这种物质不是细菌分泌到体外的毒素(外毒素,如破伤风毒素),而是不被分泌的“存在于细菌体内的毒素”,所以又被称为内毒素。LPS由三部分组成:类脂A、核心多糖、O-抗原。类脂A部分致热作用强,在LPS的生理活性表现中被认为起到重要作用。
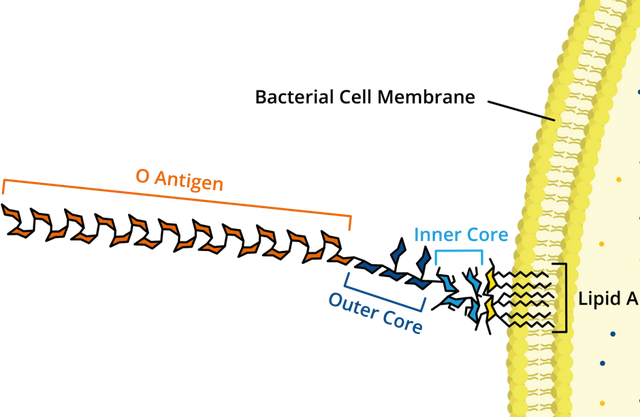
“严格地讲,不是每一种热原都是具有脂多糖结构,但是所有已知的细菌内毒素脂多糖都有热原活性”。在药品生产质量管理控制GMP条件下,药品生产的质量控制一般可以接受的观点是:不存在细菌内毒素意味着不存在热原。内毒素只是热原的一种类型。
在药物生产过程中,热原可以通过原料、溶剂、容器具带入,制备过程中污染,灭菌不彻底或包装不严也产生热原。因此生产实践中除了原料内毒素控制外,还得在制药用水、生产过程中以及产品放行中广泛进行内毒素监控,以保证用药安全。
热原的特点非常明显:耐热,注射剂通常灭菌的条件下,往往不足以破坏热原,一般在250℃加热30分钟以上才能失活;两性;吸附性;能被强酸、强碱、强氧化剂及超声波破坏等。药品生产中必须两方面进行控制,防止热原污染和污染之后设法除,检测显得尤其重要。
内毒素检测基本上只针对注射剂和医疗器械
人类与微生物世界处于一个共存的环境,健康的人也是大量微生物的宿主。但是人类在进化过程中建立了天然防御系统(如皮肤和消化道),可以将微生物及其代谢物(毒素等)限制在可以耐受的范围。但注射给药或医疗器械(如医用输液、输血、注射器、植入器械等)使得热原(如果存在)会绕过正常的身体防御,而直接进入血液循环系统,免疫系统对热原如LPS产生免疫应答,信号通路触发和级联反应,释放多种具有抗菌抗炎作用的细胞因子和趋化因子,作用于体温调节中枢引起发热,严重时能导致多脏器损伤。细菌内毒素主要针对注射剂,口服制剂和外用药物制剂一般不做内毒素检测。
内毒素导致“发热”的分子机理
制药行业内大家通常会把“内毒素”和“热原”通用,用内毒素检测替代热原检测,来监测生物制品的安全性。内毒素对宿主产生的影响是全身性的(如发烧),而不是像大多数外毒素那样严格意义上的神经学影响。内毒素对人的急性毒性相对较低,表现出低阶免疫反应。从热原产生机理角度看,注射时即使是微量的热原同样也会通过一类称为Toll样受体(TLR)的蛋白质,来触发自然免疫系统,导致恒温动物的体温异常升高。
那么,热原是如何通过免疫系统进行反应的呢?
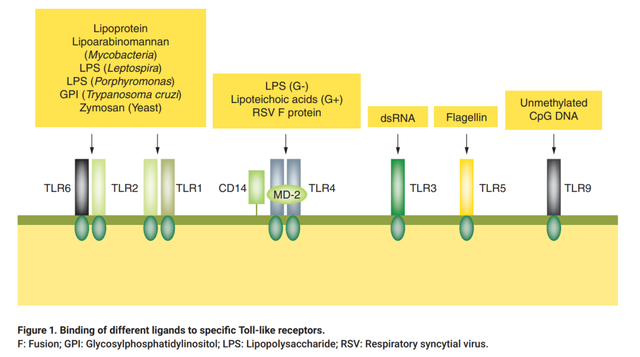
Toll样受体是跨膜蛋白,在所谓的前哨细胞(如巨噬细胞和树突状细胞)中占表达丰富,在先天免疫系统的激活中起着至关重要的作用。它们充当模式识别受体,由微生物或病原体相关分子识别触发级联反应。
迄今为止,已发现13种TLR家族蛋白,每种受体都充当一种或几种特定配体的受体,作为对潜在有害微生物或其他外源剂的反应的基础。例如,当细胞外TLR4识别大肠杆菌LPS的脂质A组分,并与其他反应协作,导致免疫细胞释放热原性细胞因子。其中两种热原细胞因子,即IL-1和IL-6,会刺激下丘脑,导致前列腺素E2的分泌,引起脑膜炎。其他LPS和NEPs也会与不同类TLR结合,触发免疫系统级联反应,产生发热反应。这种反应是身体抵抗有害病原体能力的方式,然而,内毒素导致的发热却可能致命。热原在体外对巨噬细胞以外的多种细胞也有直接作用。这些影响可能包括有丝分裂、抑制有丝分裂、诱导形态学改变和细胞毒性。
热原(内毒素)检测
鉴于热原对人体的不良反应的效果和多样性,注射用药终产品放行都必须强制进行细菌内毒素测试(BETs),以确保患者用药安全。在制药行业,特别是注射用药,对细菌内毒素进行可靠和有效的检测是重要环节。标记为无热原或无菌的注射或植入产品必须进行内毒素检测放行。许多原材料检查也必须进行内毒素检测方能用于GMP生产,以达到设计标准的质量要求。
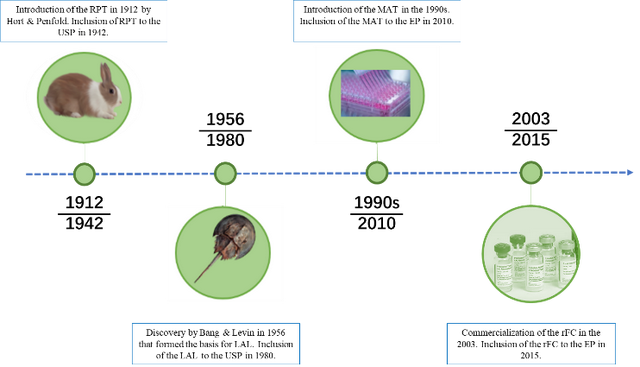
家兔热原检测法(RPT)
家兔的体温变化非常敏感,它们对许多病毒和致病菌非常敏感,具有能客观反映各类药品中热原在生物体内引起发热情况的特点。通过家兔的预先感染,可以进行许多抗传染药物的研究,因此可以作为热原试验的实验动物模型,常作为研究发热、解热药和检查致热原。虽然兔子是常用的试验动物,但人类被认为是对热原敏感的动物。
Seibert在1923提出用家兔检测热原,该方法于1942年首次被美国药典收录,简称“家兔法”(RPT),该方法个也是唯一一个设计用于药品和医疗器械热原体内检测的方法。中国药典1953年版开始收载该方法,随后的世界各国药典都以动物热原检查法作为药品质量监测的方法之一。欧洲药典也于1986年首次发布该方法,通过测量兔子通过静脉注射待测物质的无菌溶液引起的体温升高进行检测。家兔热原检查法可在规定时间里观察到家兔的体温变化,相应反应了热原质引起哺乳类动物复杂的体温反应过程,为保障药品质量和用药安全发挥了重要作用。
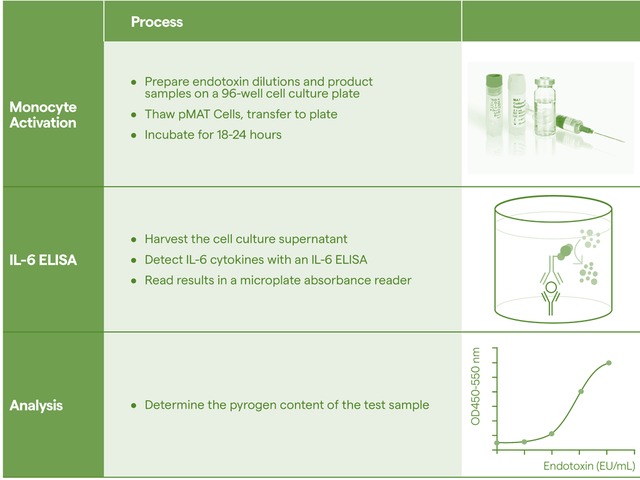
单核细胞活化反应测定法(MAT)
但RPT也存在各种局限性,例如:灵敏度较低、无法区分Endotoxin和NEP;试验动物受到药品的药理活性干扰,而影响体温变化(如放射性药品、抗生素、生物制品等),实验结果难以判断;无法应用于非静脉注射药物;兔子致命的过敏性休克的可能性;动物饲养和测试设备及实验费用;属于定性反应,实验结果和热原很难进行量的换算。
鉴于这些限制,以及欧盟为减少动物用于科学目的所做的努力,欧洲药典2010在通则2.6.30新增单核细胞活化试验(MAT)热原检测方法,为RPT提供了一种体外替代方案,能够检测内毒素和非内毒素热原,在动物福利方面向前迈出的重要一步。USP<151>也收录了MAT热原检测方法。2020年版《中国药典》通则9301“注射剂安全性检查法应用指导原则”中增加单核细胞活化反应测定法(MAT)方法。用于满足技术药物发展的现状和解决传统内毒素检查法不能满足新型产品安全性控制需求这个难题。
细菌内毒素的鲎试剂检查法(LAL/TAL)
细菌内毒素检查法又称鲎试剂法,是利用鲎试剂与细菌内毒素发生凝集反应,以检测或量化药品中因革兰阴性菌产生的细菌内毒素含量是否符合规定的一种方法。此法以其快速、灵敏、经济、重现性好等特点得到了日益广泛的应用,并有取代传统的热原检查法的发展趋势。
美国动物学家FredericBang在1956年研究鲎的血液循环时,和助手JackLevin发现细菌产生的内毒素导致的凝血机理。1968年,他们初步阐明这种血液凝固是由于革兰阴性细菌内毒素激活了鲎血变形细胞溶解物的酶,使溶解物中的可溶性蛋白变成凝胶,这种凝固反应其灵敏。开发出了一种的细菌检测剂——鲎试剂(LAL,LimulusAmebocyte Lysate,鲎阿米巴样细胞裂解物)。
根据鲎血来源不同,一般分为LAL(美洲鲎试剂)/TAL(东方鲎鲎试剂),鲎试剂检测法是一种可靠、灵敏、特异性强的内毒素检测方法,也是监管机构主要的推荐方法,应用广泛。
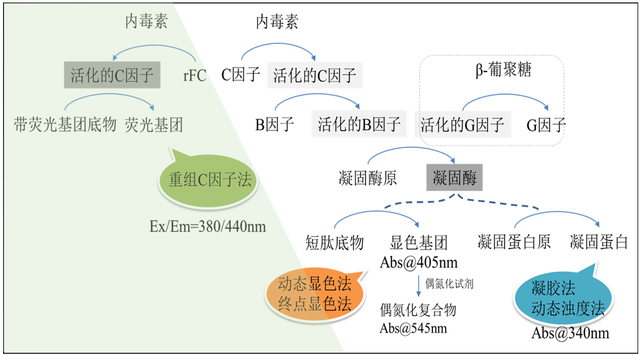
基于鲎试剂发展出来的主要内毒素检测方法包括两种:凝胶法和光度测定法,后者又包括浊度法和显色基质法。供试样品检测时,可使用其中任何一种方法进行试验。当测定结果有争议时,除另有规定外,以凝胶法检测结果为准。细菌内毒素的量用内毒素单位(EndotoxinUnit, EU)表示。
模拟鲎试验级联反应阶段,2003年以来,基于重组因子C(rFC)的细菌内毒素检测方法由于可替代动物源鲎试剂和原料可控性、抗干扰能力强等特点,被广泛用作内毒素检测的替代方法。有研究比较了LAL方法和rFC检测数据,结果显示几种方法的检测结果是可比的。重组C因子内毒素检测方法可以用于药典凝胶法和光度法的有效替代。
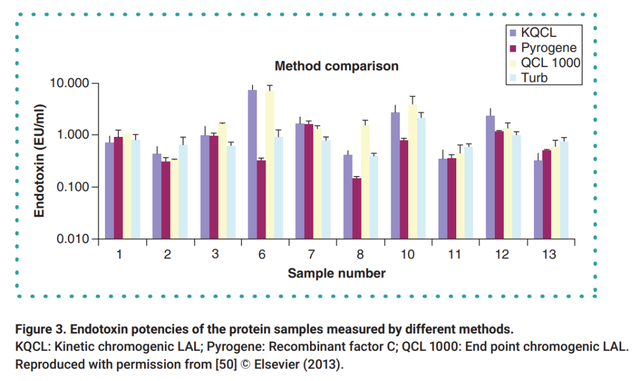
不同鲎试剂检测方法和重组C因子检测方法检测结果比较(KQCL-Lonza动态显色法试剂盒;PyroGene-Lonza重组C因子法试剂盒;QCL-Lonza终点显色法试剂盒;Turb-Lonza动态浊度法试剂盒)
因此,目前行业内共有四种常见的细菌内毒素检测方法:凝胶法、比浊法、显色法和rFC法,并在注射剂和医疗器械生产过程控制和产品放行质控检测中有着重要的应用。比浊法、显色法和rFC法是定量方法,凝胶法为定性或者半定量方法。每种方法都有自己的特点,使用者可以根据自己的样品属性、检测需求和实验室设备情况和法规要求进行相应选择,以达到内毒素控制和热原控制的效果,保证患者安全。
Lonza内毒素检测产品一直走在行业尖端
Lonza(龙沙)内毒素产品于1970年代面世,生产符合U.SLisenceNo.1775许可。半个世纪以来,为全球客户提供包括细菌内毒素检测试剂盒、内毒素检测软件、全自动内毒素检测仪器在内的一站式解决方案,符合FDA21 CFR part 11和欧盟EUGMP附录11法规要求,以服务于各类细胞制剂生产企业、制药企业质控部门,可植入医疗设备和透析样品质控以及科研院所等相关机构,其服务对象覆盖70%的制药100强企业,已用于国外大量药物的放行上市,满足出口型制药企业的规模化热源测定需求。
产品包括:鲎试剂凝胶法试剂盒;基于鲎试剂,用于定量检测的动态显色法试剂盒,动态浊度法试剂盒;不依赖于鲎试剂的重组C因子检测试剂盒。LAL试剂可以实现产品的稳定供应。
此外,Lonza还提供PyroCell®MAT单核细胞活化反应测定法系统,高度敏感和可靠的用于复杂配方(如人类疫苗和基于细胞的生物制剂)的体外热原检测。

Lonza LAL鲎试剂及重组C因子内毒素检测系统产品特点:
产品快速通道:
PyroGene 重组因子 C 内毒素检测试剂盒-Lonza-龙沙-上海玮驰 (weichilab.com)
Kinetic-QCL 动态显色法内毒素试剂盒-Lonza-龙沙-上海玮驰 (weichilab.com)
PYROGENT-5000动态浊度法内毒素检测试剂盒-Lonza-龙沙-上海玮驰 (weichilab.com)
内毒素自动化系统-PyroTec™ PRO-Lonza-龙沙-上海玮驰 (weichilab.com)
联系我们:
销售咨询:张经理15895555869
技术咨询:李经理15121038345
渠道合作:顾经理13564627120
重组C因子与基于LAL的测试方法具有可比性。使用PyroGene 重组C因子产品进行的4种产品内毒素检测时,结果均在可接受范围以内。对于具体产品的方法选择,可以根据产品的性质来进行确定。
赛桥生物致力于实现CGT工业级核心装备的封闭化、自动化、柔性化、 数字化和智能化,加速推动国产替代,已构建设备与耗材能力平台,完成全套工艺模块的开发,包括全封闭自动化血细胞分离、磁珠激活分选、电转染、细胞扩增、清洗浓缩、制剂分装等设备,以及配套的系列化GMP一次性密闭耗材。力争突破进口垄断、为行业客户提供完全国产自主可控的CGT数字化工艺装备平台。
低温样品的移动基站——斯特林 Stirling ULT25NEU 车载便携式超低温冰箱可用于远程临床试验样本采集、实验室小批量样本存储和生物药物配送,为实验室、科研机构生物样品的超低温贮存和运输赋能。
Online Message